Meeting Summary
El tercer Encuentro Latinoamericano de Infecciones Respiratorias Recurrentes (ELAIR) tuvo lugar en Ciudad de México, México, los días 11 y 12 de mayo de 2017. ELAIR reunió a expertos de toda Latinoamérica y otros países, continuando con un extraordinario ejercicio didáctico en cuanto a los vanguardistas avances de la medicina respiratoria. En los últimos 15 años se ha realizado un progreso espectacular gracias a la aparición de nuevos tratamientos disponibles para gestionar y evitar infecciones en las vías respiratorias. Queda por ver cómo podría afectar todo esto a las afecciones relacionadas de las sibilancias y el asma en los sujetos predispuestos e hipersensibles. No obstante, los primeros datos sugieren que las tasas más bajas de infección en las vías respiratorias podrían reducir el desarrollo de las afecciones antes mencionadas, estrechamente relacionadas con las infecciones víricas. Es probable que los inmunorreguladores que preparan el sistema inmunológico para combatir la infección y que además reducen la inflamación jueguen un papel fundamental en la prevención secundaria (e incluso potencialmente primaria) de las enfermedades atópicas.
FISIOPATOLOGÍA DEL ASMA: ROL DE LAS INFECCIONES DE LAS VÍAS RESPIRATORIAS
El asma es un problema de salud pública grave con una prevalencia conservadora a nivel mundial de 235 millones de personas. La carga económica (>18 mil millones de $ al año en EE. UU.) y humanitaria del asma afecta de forma más intensa a los países en desarrollo, en los que la gestión tiende a ser más deficiente, lo que aumenta el riesgo de exacerbaciones y sus consecuencias, como pueden ser las hospitalizaciones y el absentismo. En los países desarrollados, los miembros más vulnerables de la sociedad, como los niños y las minorías, presentan un mayor riesgo de padecer asma.1
El asma en Latinoamérica
Latinoamérica ocupa un 13 % de la superficie terrestre y alberga aproximadamente a 600 millones de personas. A pesar de que se suele contemplar como un bloque cultural homogéneo, la región es muy diversa y cuenta con una gran variedad de características sociodemográficas, diferentes idiomas y religiones, y servicios de salud con estructuras y recursos dispares. Actualmente, el conocimiento que hay en la región acerca de la prevalencia del asma y de los factores que la provocan es precario;2 sin embargo, los datos que se manejan indican que el asma es un problema de salud significativo en Latinoamérica. En el Estudio Internacional sobre Asma y Alergias en la Infancia (ISAAC), en su fase del 2009, los países latinoamericanos se encontraban, a menudo, en la categoría más alta en cuanto a prevalencia (≥20 %).3 De acuerdo con un análisis sistemático reciente, la prevalencia osciló entre el 7 % de México y el 33 % de Perú (Figura 1).2
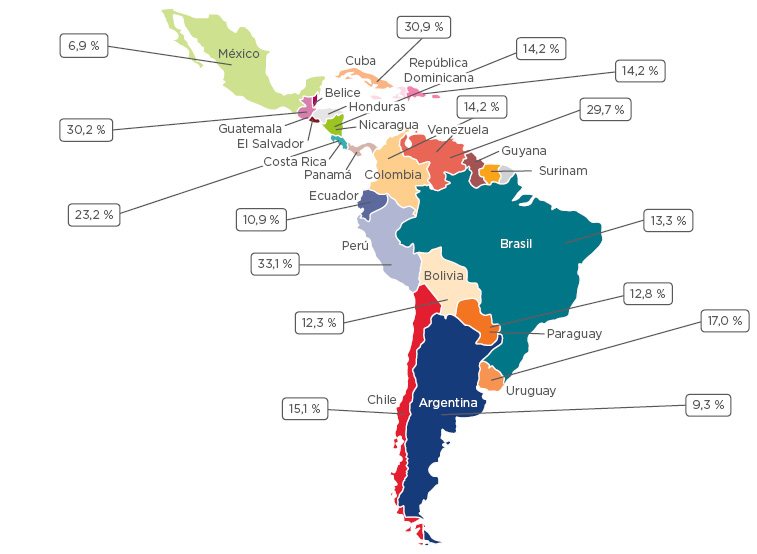
Figura 1: Prevalencia del asma en países de Latinoamérica.2
Historia natural del asma y las sibilancias
El asma grave se asocia a una calidad de vida reducida, al absentismo escolar y laboral y a un aumento de los costes sanitarios. Los datos que se desprenden del estudio de cohorte longitudinal que lleva más tiempo activo, y que dio comienzo en los años 70, indican que un control deficiente durante la infancia se traduce en el aumento de la gravedad y la morbilidad en la edad adulta.4-7 El debate existente es si el aumento de la prevalencia del asma refleja un cambio epidemiológico real o si está determinado por una mejora de la detección. Sin embargo, el peso de la evidencia sugiere que la prevalencia mundial real va en aumento. El conocimiento de los factores de riesgo ha mejorado sustancialmente en las últimas décadas, lo que ha permitido que los investigadores estudien la posibilidad de que el aumento de la exposición explique el crecimiento de la prevalencia del asma. Los factores de riesgo podrían ser específicos en cada región; por ejemplo, la contaminación y la dieta en los países de Europa del Este y la obesidad y el estrés en los países de Occidente. La diversidad de Latinoamérica hace que todos los factores de riesgo existentes estén localizados dentro de la región.1,2
La exposición a los factores de riesgo de padecer asma podría originarse en la etapa prenatal por causa del humo del tabaco y la dieta materna. Varios de los factores sensibilizadores postnatales incluyen la exposición a ácaros, tabaco, contaminación, ozono, infecciones y carencias de vitamina D.8 Los datos relativos a Latinoamérica sugieren que factores sociales como la exposición a la violencia, podrían, también, incidir en un aumento de la prevalencia del asma.8-10 Los tres factores principales que predisponen a dicha prevalencia probablemente sean la genética, la contaminación y la exposición temprana a las infecciones virales. Estos factores de riesgo tan genéricos comparten una consecuencia común: el aumento de los cambios pro-inflamatorios, que conforman la base de la fisiopatología del asma.8
Definiciones, genética, fenotipos y fisiopatología
El asma no está ya considerada como una enfermedad, sino como un grupo heterogéneo de trastornos que tienen como consecuencia una obstrucción bronquial reversible y recurrente que se caracteriza por la inflamación, la hiperreactividad de las vía respiratorias y la limitación del flujo aéreo.11,12 La definición de un grupo heterogéneo de trastornos supone todo un reto. La definición clásica del asma caracteriza el trastorno en relación con episodios recurrentes de falta de aire, tos y sibilancias, que tienen lugar, principalmente, por la noche. Si usamos esta definición, la mayor parte de los pacientes tiene una enfermedad leve, y corre el riesgo de no ser debidamente diagnosticada, de no recibir el tratamiento correcto y de carecer de un control adecuado. La definición fisiológica se centra en la limitación del flujo aéreo y en la presencia de biomarcadores inflamatorios. En Latinoamérica, la espirometría para detectar el flujo aéreo está infrautilizada, sobre todo, en niños, y, en algunos casos, ni siquiera está disponible. Finalmente, la definición patológica se centra en la inflamación crónica, con o sin cambios en el flujo aéreo, incluido el remodelado.
No es fácil encontrar una definición en base al genotipo, ya que, hasta ahora, se han identificado >100 genes asociados al asma. El asma tiene, además, diferentes fenotipos, que incluyen el asma episódica, la inducida por el ejercicio y el asma atópica. Recientemente se ha propuesto la definición vía endotipo, por la que el subtipo de la enfermedad se clasifica a través del mecanismo fisiopatológico específico. El requisito de considerar la influencia de la epigenética en la expresión genética hace aún más complejo el ya de por sí complejo entorno multifactorial.
El amplio rango de heredabilidad (35−95 %) está en consonancia con los múltiples genes asociados, los endotipos y los mecanismos. Los datos sugieren que los polimorfismos de nucleótidos simples tienen poca influencia en el riesgo de padecer asma. Los estudios de las variantes genéticas comunes sugieren relación con infecciones virales o mecanismos de carencias de vitamina D; sin embargo, hasta ahora, los estudios genéticos no han progresado demasiado hacia la utilidad pronóstica.11 La población de Latinoamérica parece compartir una gran superposición de genes candidatos con otras poblaciones, incluidos el factor transformador del crecimiento Beta 1 (TGF-β1), locus 17q21, interleukin (IL)-13, glutation S-transferasa Mu 1 (GSTM1), metaloproteína matrix (MMP) 9 y el receptor adrenérgico ß2 (ADRβ2). Los genes asociados a la gravedad del asma, la carencia de vitaminas D y E, y la obesidad, como la linfopoyetina estromal tímica y el MMP12, fueron identificados, por primera vez, en Latinoamérica. Los estudios epigenéticos han identificado, además, interacciones entre los genes candidatos relacionados con los genes IL-10, TGF-β1 y los alérgenos de los ácaros del polvo, y la anteriormente mencionada conexión con la exposición a la violencia está relacionada con la metilación del ADN del gen ADCYAP1R1.
Los tres fenotipos clásicos de sibilancias tempranas transitorias, sibilancias no atópicas y asma/sibilancias asociada a la inmunoglobulina (Ig)E se han dividido en seis endotipos fisiopatológicos de sibilancias, presentados aquí en orden ascendente de persistencia: nunca o con poca frecuencia, remisión de aparición en edad preescolar, remisión de aparición durante la infancia, persistencia durante la edad escolar, persistencia en infancia tardía y sibilancias continuas.13,14 En un estudio de cohorte longitudinal, la prevalencia de estos fenotipos era de 60,0 %, 19,0 %, 7,5 %, 4,3 %, 4,7 % y 4,9 %, respectivamente.14 La caracterización detallada del asma en endotipos asociados con características como el grado de participación de la IgE y el colaborador T (Th)2, la relación con la obesidad, la predominancia de IL-5 y las relaciones con la respuesta agonista de esteroides y ß2, representa un gran reto en el campo.
Los procesos inflamatorios, influidos por factores tanto genéticos como medioambientales, son fundamentales para la patogenia del asma. Datos más recientes sugieren un rol central para el epitelio respiratorio en el asma. Los patógenos, los alérgenos y los contaminantes activan receptores de señales en el epitelio respiratorio, a través de patrones moleculares asociados a patógenos, patrones moleculares asociados al daño (también llamados alarminas) y alérgenos, lo que deriva en la liberación de tres citocinas principales: IL-25, IL-33 e linfopoyetina estromal tímica.15,16 La producción resultante de las citocinas Tipo 2, sobre todo las IL-4, IL-5 e IL-13, tiene como consecuencia un aumento en el tráfico de células dendríticas inmaduras presentadoras de antígenos al epitelio y un aumento del procesamiento antigénico. Estas células dendríticas impulsan, entonces, la diferenciación de células T, favoreciendo, a menudo, a las células Th2 y los procesos inflamatorios consiguientes.15
Las biopsias bronquiales de los pacientes con asma muestran una inflamación significativa de las vías respiratorias caracterizada por la presencia de eosinófilos, linfocitos, neutrófilos, y células mastoides. Podrían tener lugar, además, cambios estructurales como hipertrofia del músculo liso y denudación epitelial. Aunque sigue siendo importante, la posición de los eosinófilos como mediador clave del asma ha sido reemplazada por el epitelio de la vía respiratoria, sobre todo durante las exacerbaciones, y las células Th2, que son concluyentes para determinar si el asma es atópica o no atópica. El rol de los neutrófilos y el estrés oxidativo ha adquirido una gran importancia en los últimos años.17,18 Las pautas sobre tratamiento del asma que se han publicado recientemente en México19 proponen dos ramas principales en la fisiopatología del asma: la rama Th2/ILC2/NKT, que resulta en inflamación eosinofílica en una forma dependiente de la IgE (Th2) o independiente (ILC2/NKT), y la rama Th1/ILC1/Th17/ILC3, que conlleva la inflamación neutrofílica por medio de una vía dependiente de interferón-y (Th1/ILC1) o dependiente de la IL-17 (Th17/ILC3). En última instancia, ambas vías tienen como resultado el broncoespasmo asociado a las exacerbaciones del asma.19
Los cambios del tejido provocados por el asma incluyen la infiltración de las células inflamatorias y la hiperplasia de las células mucosas. Los aumentos del engrosamiento de la membrana basal subepitalial en la masa del músculo liso a través de la hipertrofia y la hiperplasia, y la presencia de tapones mucosos son características típicas del asma.20 El inicio promedio del asma se da a los 3 años en el caso del hombre y de los 8 en el caso de la mujer; en el hombre, el 80–90 % de los casos tiene lugar antes de los 4 años.21 Anteriormente se pensaba que el remodelado de las vías aéreas tenía lugar tan solo en casos crónicos o graves, y especialmente en adultos. Sabemos ahora que este no es el caso, ocurre en niños, y podría estar presente independientemente del nivel de gravedad. Los datos actuales sugieren que los cambios patológicos pueden comenzar también en un estadio temprano de la enfermedad. El aumento de las células inflamatorias y los leucotrienes es evidente en niños <3 años con sibilancias persistentes.22 Parece ser que el engrosamiento de la membrana basal y la infiltración eosinófila tienen lugar entre los 1 y 3 años de edad, aunque no se dan en niños más jóvenes con sibilancias persistentes.23,24
El rol de la infección
Los microbios presentan una dicotomía en el riesgo de asma. Para el desarrollo del sistema inmune y para evitar la atopia, es fundamental tener un microbioma equilibrado, mientras que los patógenos infecciosos aumentan el riesgo de desarrollar asma y exacerbaciones.25
La hospitalización por bronquiolitis asociada a virus sincicial respiratorio (VSR) o a rinovirus durante la infancia está muy relacionada con la presencia de alergia o asma más adelante.26,27 Durante el primer año de vida, las sibilancias por rinovirus es uno de los factores pronósticos más sólidos de sibilancias a los 3 y 6 años, y un VSR que desemboca en sibilancias durante los primeros años de vida aumentó la prevalencia de asma a, aproximadamente, el 40 % hacia los 18 años de edad, frente al 9 % en pacientes de control.26,28-30
Si comparamos los dos patógenos directamente, las sibilancias asociadas a rinovirus (razón de momios, RM – [OR]: 9,8) en los primeros tres años de vida constituye un riesgo significativamente superior de padecer asma hacia los 6 años que en el caso del VSR por sí solo (RM: 2,5). Además, la combinación de rinovirus y VSR (RM: 10,0) solo confirió un riesgo ligeramente superior al rinovirus por sí solo. En total, un 90 % de los niños que experimentaron sibilancias debidas a rinovirus a los 3 años sufrieron de asma a los 6 años.31 Este patrón continúa en la adolescencia, con el aumento del riesgo de padecer asma en casos de sibilancias causadas por rinovirus en los primeros 3 años, ajustado en el caso de sibilancias causadas por otras infecciones, hasta los 13 años, a partir de cuando el VSR ya no supone un riesgo (RM: 1,0). La infección temprana (<1 año de edad) con rinovirus tiene como consecuencia un riesgo mayor de padecer asma durante los 5 primeros años de vida.32
En un estudio prospectivo a largo plazo de pacientes con bronquiolitis grave por VSR (N=206), un 73 % de los niños manifestaron sibilancias a los 3 años y un 30 % de los pacientes recibieron un diagnóstico de asma a los 5 años de edad. A los 13 años, el VSR que provoca bronquiolitis grave resulta en una RM de 9,3 en el desarrollo de asma o sibilancias recurrentes.29 En un estudio realizado en Costa Rica (datos no publicados) se observó un patrón similar. Se contactó con los niños (N=172) hospitalizados por bronquiolitis durante su primer año de vida, el 25 % de los cuales fueron prematuros, a los 6-7 años. Aproximadamente un 40 % de los pacientes había sido diagnosticado con asma, un 73 % había sufrido episodios de sibilancias, un 3 % tuvo que utilizar los servicios de urgencias y un 50 % había recibido tratamientos de nebulización.
En un estudio que investiga las infecciones no virales, la colonización bacteriana en la región hipofaríngea en niños sin síntomas se asoció al padecimiento de sibilancias/asma a la edad de 5 años (RM: 4,5; 95 % intervalo de confianza [IC]: 2,18–9,57). Además, el riesgo de hospitalización fue también superior en los colonizados neonatos. De las cuatro bacterias investigadas, el riesgo era superior en los casos de colonización por Streptococcus pneumoniae, Haemophilus influenza y Moraxella catarrhalis, pero no por Staphylococcus aureus.33
Los datos intervencionistas prospectivos acerca de palivizumab, un anticuerpo monoclonal que lucha contra el VSR, reafirman el vínculo casual encontrado entre la infección viral y las sibilancias y el asma. El uso de palivizumab está recomendado en niños de alto riesgo, como los bebés prematuros, y con él se ha logrado una reducción de aproximadamente un 50 % en la tasa de infección.34 El estudio de doble cohorte, multicéntrico, apareado investigó la prevalencia del asma en niños prematuros tratados con palivizumab. Los niños prematuros a los que se trató con palivizumab durante la estación anterior y que no fueron hospitalizados por VSR en el invierno siguiente (n=191) coinciden con dos grupos de control que habían sido hospitalizados (n=76) o no (n=154) por VSR. La terapia con palivizumab dio como resultado una reducción del riesgo relativo de padecer sibilancias recurrentes entre los 2 y los 5 años en pacientes sin historial familiar de atopia (reducción del 80 %) o asma (reducción del 68 %).35 No se observó una reducción en pacientes con un historial familiar de atopia, por la que los pacientes corren un mayor riesgo de padecer asma más adelante. Los resultados similares en ensayos aleatorios controlados demostraron una reducción significativa en las sibilancias acumuladas en los primeros 12 años de vida en niños prematuros tratados con palivizumab.36 Existe un artículo que confirma estos datos y que sugiere que la administración de palivizumab en niños prematuros suprime las sibilancias recurrentes durante los primeros 6 años de vida, sin embargo, no suprime el inicio del asma atópica. Así, se reduce la morbilidad pese a que no se previene el desarrollo del asma.37 Estos datos están en concordancia con la hipótesis de que, para evitar el desarrollo del asma, han de acatarse tres ramas de riesgo: los impulsados por la alergia, las infecciones virales y el microbioma de las vías aéreas, lo que supone un reto significativo para el sistema sanitario.38
La importancia del entorno microbiano en el desarrollo del asma se ha ilustrado de forma elegante en dos estudios comparativos de los índices de asma entre niños de las comunidades amish y huterita. Aunque son genéticamente muy parecidos, la exposición a endotoxinas en el polvo era 6,8 veces más alta en el caso de los niños amish, lo que implica un índice de sensibilización de 4 a 6 veces inferior, en comparación con los niños huteritas. Los autores identificaron una exposición del sistema inmune innata a un entorno microbiano rico como el origen de las diferencias relativas a alergia y asma entre las dos comunidades.39,40
Diagnóstico del asma
La variabilidad en la presentación del asma y los cambios dependientes de la edad en los patrones sintomáticos de los niños añade un nuevo estrato de complejidad al diagnóstico del asma. Un buen historial clínico, con el conocimiento de los antecedentes familiares, los factores de riesgo y las infecciones previas es clave, como también lo son un examen físico riguroso y diagnósticos diferenciales para descartar otros trastornos, como la presencia de cuerpos extraños o fibrosis quística, o comorbilidades como rinitis alérgica, sinusitis y reflujo gastroesofágico.
El diagnóstico rápido y preciso es especialmente importante en lactantes y niños en edad escolar debido a una prevalencia alta de sibilancias y morbilidad relacionada. En este grupo etario, el 48 % de los niños ha experimentado una exacerbación en los 12 meses anteriores. Los lactantes y los niños en edad preescolar sufren los episodios más graves de exacerbaciones debido a causas virales y tienen los peores síntomas además de tener que ser hospitalizados más veces.41 Sin embargo, la heterogeneidad, los perfiles de síntomas superpuestos y una falta de objetivos o medidas prácticas hacen que el diagnóstico sea particularmente difícil. Los diagnósticos diferenciales comunes incluyen infecciones virales recurrentes, reflujo gastroesofágico, aspiración de cuerpos extraños, broncomalacia, fibrosis quística, discinesia ciliar primaria y anillo vascular, entre otros.
En niños ≤5 años, el historial clínico es fundamental ya que puede ayudar en caso de que los episodios sean recurrentes o persistentes, o si están relacionados con el ejercicio o los desencadena la exposición a contaminación ambiental. Estos detalles podrían ayudar en el diagnóstico del endotipo de asma presente. Deberían considerarse los antecedentes familiares de enfermedades alérgicas, especialmente los de los parientes de primer grado. Finalmente, la mejoría clínica durante 2-3 meses de tratamiento y el empeoramiento tras la supresión son un indicativo de asma.
Guías de tratamiento
Existen diferentes pautas de tratamiento para el asma, sin embargo, sus mensajes están en sintonía. Las pautas de tratamiento para el asma publicadas recientemente en México integran aspectos de pautas del Reino Unido, de la Iniciativa Global para el Asma (GINA), de España y de Australia, adaptándolas desde la muy variada naturaleza regional de México.19 Los objetivos incluyen el control adecuado de los síntomas y la tolerancia al ejercicio, reducción de exacerbaciones, eliminación de los efectos secundarios y mantenimiento de la función pulmonar normal. Los factores regionales y culturales que afectan a la táctica de tratamiento para el asma deberían personalizarse en función de las necesidades individuales de los pacientes, en relación con sus creencias y prácticas culturales o étnicas. Los objetivos del tratamiento siguen siendo iguales, independientemente de factores sociales o económicos.
Los pasos recomendados en el tratamiento de niños, especialmente en niños <5 años, empiezan por la regla de oro de esteroides inhalados a diario en dosis bajas. La mayoría de los pacientes responderá a esto sin que haya que subir o doblar la dosis y sin necesidad de la evaluación por parte de un especialista. Por desgracia, los paradigmas de tratamiento actuales no modifican la evolución de la enfermedad y la supresión del tratamiento tendrá como consecuencia una manifestación de síntomas y función pulmonar similares a los de un individuo no tratado en el mismo estado de la enfermedad.42
Son necesarios varios componentes para controlar el asma. En primer lugar, ha de escogerse el tratamiento más adecuado para el paciente. En la mayoría de los pacientes con asma leve existen tratamientos adecuados para controlar la enfermedad. Sin embargo, hay que abordar otros factores que podrían afectar a la capacidad de controlar el asma que tiene un paciente. Las dificultades económicas podrían impedir el acceso al tratamiento; las carencias en la educación parental podrían afectar a ciertos aspectos relacionados con el control; podrían necesitarse espaciadores que deberían proporcionarse siempre que fueran necesarios; la falta de adherencia (~70 %) ha de ser atendida, y los factores de riesgo o desencadenantes, como el tabaco, deberían reducirse al máximo. La medida expuesta anteriormente será también útil en el 5 % de los pacientes con asma grave que corren el mayor riesgo de padecer exacerbaciones.
Manejo de las sibilancias y las exacerbaciones asmáticas
El control del asma implica diferentes medidas para cada tipo de persona. Desde la perspectiva del paciente, el control puede significar vivir una vida plena, poder ir a trabajar o al colegio, participar en actividades y dormir tranquilo. El médico suele centrarse en los resultados a largo plazo, por ejemplo, evitar el uso excesivo de esteroides, debido a las consecuencias que pueden tener, con el tiempo, en la densidad de los huesos. Desde el punto de vista del sistema sanitario en general, la reducción de costes y de la carga de la enfermedad constituyen la panacea. Por suerte, el mantenimiento del control fisiológico y la evitación de exacerbaciones suponen el logro de todos estos objetivos a largo plazo.
Control actual
Existe una relación logarítimica entre los resultados de las pruebas de control de asma, que indican un control peor, y mayores posibilidades de exacerbaciones.43 Los pacientes con un asma controlada o no controlada tienen, respectivamente, entre dos (RM: 1,97; 95 % IC: 1,53–2,54) y seis veces (RM: 5,74; 95 % IC: 4,52–7,29) más probabilidades de padecer exacerbaciones frente a los pacientes bajo control absoluto.44
Los datos de 2005 sugieren que el control en Latinoamérica no fue adecuado durante dicho período. Para el estudio sobre Realidad y Percepciones del Asma en Latinoamérica (AIRLA)45 (N=2184) se encuestó a adultos con asma y a padres de niños afectados sobre el uso del servicio sanitario, la gravedad de los síntomas, la limitación de actividades y el uso de medicación. Casi un 50 % de adultos y niños padecía síntomas cada día y cada noche. Los síntomas durante la práctica de ejercicio eran comunes (40 %) y la mayoría de los adultos manifestó que su capacidad de practicar ejercicio estaba limitada. También eran normales los trastornos del sueño y la limitación en actividades diarias. La mayor parte, tanto de adultos como de niños, había tenido que acudir a los servicios de urgencias, y cerca de tres cuartas partes de los niños tuvieron que recibir un tratamiento de urgencia. Las visitas a los servicios de urgencias fueron más comunes en el caso de los niños, lo que probablemente se debe al mayor índice de infecciones virales en este grupo etario. Sorprendentemente, <3 % de los pacientes cumplían con los criterios de la GINA relativos al control del asma. Otro motivo de preocupación fue la subutilización de corticosteroides inhalados en todos los grupos de gravedad (es decir, el 6 %), lo que refleja una falta de adherencia, en general, a las pautas. Las percepciones de pacientes en cuanto al control del asma no estuvieron demasiado en consonancia con el estudio de AIRLA. Un 40 % de los encuestados percibía el asma como bien controlada en contraposición con el 2 % de los casos de asma controlada según los criterios de la GINA.45 Se muestran todos los datos en el Figura 2.
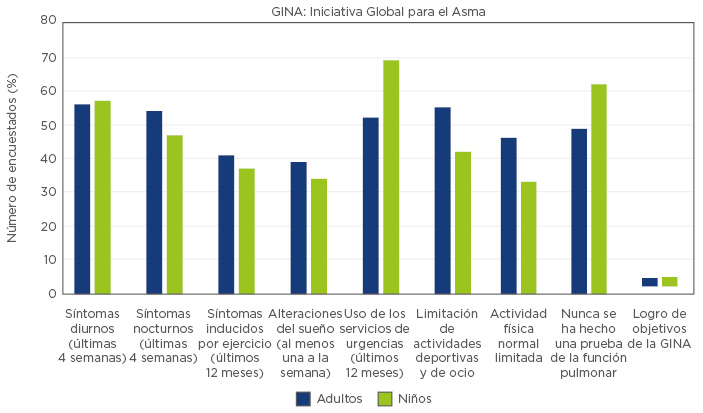
Figura 2: Índices de control del asma en Latinoamérica según el estudio AIRLA.45
En el asma, como ocurre con todas las enfermedades crónicas, el riesgo de desarrollar la enfermedad crece con el tiempo y la exposición a los factores de riesgo se acumula. Sin embargo, los datos procedentes del estudio de Melbourne sobre asma a largo plazo (MESCA), 1964−2007, indican que, a pesar de la acumulación a largo plazo, el mejor factor predictivo único para el asma grave a los 50 años es el asma grave durante la infancia.7 Por lo tanto, gran parte de los niños incluidos en el estudio AIRLA con una falta de control oculta debido a una interpretación errónea por parte de la familia representa un alto riesgo para las enfermedades graves futuras en la población (Figura 2). Además, los datos recientes indican que hay una superposición fenotípica significativa entre el asma y la enfermedad pulmonar obstructiva crónica, y tanto niños como adultos con deterioro de la función pulmonar corren un riesgo mayor de padecer una obstrucción fija de las vías respiratorias, y, posiblemente, una enfermedad pulmonar obstructiva crónica en la adultez temprana.46
En Finlandia, un programa nacional redujo la morbilidad por asma y su impacto en la sociedad y en los individuos, ilustrándose así la capacidad de influir en el cambio positivo a largo plazo.47 Mejoras parecidas se han logrado también en Latinoamérica, donde el desarrollo de pautas en base a la GINA dieron como resultado una disminución constante de las hospitalizaciones desde 1997 en adelante. La introducción del tratamiento asequible con corticosteroides con beclometasona y la adopción del mismo por parte de los médicos generales ha tenido un impacto muy positivo. Entre 1997 y 2011, la hospitalización de niños y adolescentes se redujo en un 50−60 %, y las reducciones en el caso de los adultos fueron de 50−74 %. Se dieron también reducciones marcadas en la mortalidad en todos los grupos etarios durante este período, claramente relacionadas con las mejoras en la concienciación de los médicos y en sus maneras de recetar. 48
Exacerbaciones y sus desencadenantes
Tanto si el asma está controlada como si no, las exacerbaciones tienden a estar relacionadas con factores desencadenantes. Entre los muchos factores posibles, el principal es la infección viral, especialmente entre niños más jóvenes. Aproximadamente un 85 % de los niños que experimentan un ataque de asma agudo están aquejados, en el momento del episodio, de una infección viral. Entre los niños hospitalizados por sibilancias, es común que los de <3 años padezcan VSR, virus de la gripe y rinovirus, mientras que el rinovirus es más común en los >3 años.49 Otros factores de riesgo en niños <5 años incluyen síntomas no controlados de asma, ≥1 exacerbación grave en los anteriores 12 meses, estaciones, humo de tabaco, contaminación del aire en exteriores o interiores, alérgenos de interior, problemas psicológicos o socioeconómicos, adherencia pobre o espaciador incorrecto o técnica de inhalación incorrecta, ejercicio, aire frío y medicaciones.
En niños <2 años, las sibilancias virales suelen asociarse a factores de riesgo que incluyen la exposición al humo del tabaco, función pulmonar reducida y falta de lactancia materna. En los niños más mayores, las sibilancias virales suelen asociarse a IgE elevada, sensibilización a alérgenos inhalados y asma materno. En un estudio de Costa Rica,50 se examinó a niños con asma no controlada que habían sido ingresados en urgencias con exacerbación, y el rinovirus fue identificado como el agente causal principal. La sensibilización alérgica a los ácaros, que se muestra a través de títulos altos de IgE, fue un factor de riesgo significativo en sibilancias asociadas a rinovirus en dichos pacientes (RM: 31,5; 95 % IC: 8,3–108,0). Estos datos están en consonancia con un estudio contemporáneo que muestra que los niños sensibilizados a alérgenos corrían un mayor riesgo de desarrollar sibilancias virales (índice de riesgo: 1,9; 95 % IC: 1,2–3,1).51
La infección causada por el parásito áscaris lumbricoides es un factor de riesgo de exacerbaciones de asma específico de la región en Costa Rica. Los pacientes infectados con A. lumbricoides manifestaron eosinofilia, función pulmonar disminuida y un aumento de la hipersensibilidad de las vías respiratorias, además de un mayor riesgo de hospitalización por asma (RM: 3,08, 95 % IC: 1,2–7,7).52 La contaminación aérea es otro asunto de particular importancia en la región de Latinoamérica y, debido al cambio climático, parece que va a empeorar más aún.53-55 La contaminación de interior suele asociarse a los síntomas del asma y al uso de medicación de rescate. El problema es particularmente prevalente debido a la pobreza y al uso de combustible en la cocina. 56 Como era de esperar, los datos recabados en los meta-análisis indican que el tabaco fumado por los padres y el tabaquismo pasivo aumentan el riesgo de sibilancias (RM: 1,41) y asma (RM: 1,85) en niños <2 años y el riesgo de desarrollar asma en niños de 5-18 años (RM: 1,23).57
El impacto de la dieta y la deficiencia de vitamina D también se están estudiando entre los niños de Costa Rica que padecen de asma (N=616). El 28 % de niños con niveles de vitamina D por debajo de los recomendados obtuvieron los niveles más altos de IgE y eosinófilos, acudieron a los servicios de urgencias y fueron hospitalizados con más frecuencia, recibieron más tratamiento con anti-inflamatorios y padecían de más hiperreactividad bronquial.58
Tal como se ha apuntado anteriormente, la pobreza está relacionada con los factores de riesgo de las exacerbaciones de asma. El ciclo de la pobreza arrastra a la gente a las enfermedades e impide que se desarrolle su capacidad de controlarlas. La pobreza limita las oportunidades socioeconómicas, lo que tiene como consecuencia un comportamiento arriesgado y una mayor exposición a los factores de riesgo del asma. Cuando la enfermedad se arraiga, el acceso limitado a cuidados sanitarios aumenta la probabilidad de exacerbaciones lo que, a su vez, podría derivar en ausencias en el trabajo y un aumento de la pobreza, agravándose así, aún más, la situación.
Gestión de la exacerbación
Las exacerbaciones asmáticas son una emergencia médica que puede llevar a una disminución dramática de la función pulmonar a corto plazo, seguida por un retorno a valores por debajo de los iniciales. El resultado es un deterioro progresivo de la función pulmonar, lo que, en los casos graves, es más acusado. Su característica clínica principal consiste en la reducción del flujo aéreo espirado, que puede medirse por sibilancias, disnea progresiva, hiperventilación que conduce a hipoventilación y por medio de un test de la función pulmonar (volumen espiratorio forzado en el primer segundo).59,60 Los factores que aumentan las probabilidades de muerte por exacerbación asmática incluyen una exacerbación casi letal previa, intubación previa, hospitalización en el año anterior, >2 visitas previas a los servicios de urgencias, el uso de corticosteroides orales o de agonistas ß2 de acción corta por control, y cuestiones psicosociales.61
Fisiopatológicamente, se dan tres trastornos durante una exacerbación: broncoconstricción, inflamación e hipoxemia. Estos pueden corregirse con el uso prematuro de agonistas ß2 de acción corta, esteroides y oxígeno, respectivamente. No se recomiendan ya los nebulizadores para el tratamiento de asma debido al tiempo que tardan en aplicarse, al tiempo de espera, a lo elevado de su precio y a que su portabilidad es limitada. Sabiendo cómo usarlos adecuadamente, los inhaladores o espaciadores tienen la ventaja de que su tiempo de aplicación es menor, no tienen tiempo de espera, su costo es inferior y son portátiles. Durante una crisis, los niños tratados con inhaladores de salbutamol en casa tienen más probabilidades de llegar al hospital en un estado significativamente mejor que los que no lo usan en casa. Sin embargo, los espaciadores deben tener el tamaño adecuado para cada paciente, permitir la inhalación rápida del corticosteroide y aplicarse de forma que no se restrinja aún más la respiración.
La mayor parte de las pautas de tratamiento de Latinoamérica y el resto del mundo son similares a las recomendadas por la GINA. La primera parte consiste en una evaluación para determinar si la exacerbación es leve, moderada o grave/potencialmente mortal. En una crisis leve o moderada, debería empezar a suministrarse inmediatamente al paciente agonistas ß2 de acción corta, además de oxígeno, si fuera necesario. No se recomiendan los esteroides a no ser que la crisis sea grave y se requiera una hospitalización, ya que sus efectos son perjudiciales para el desarrollo de los huesos. El sulfato de magnesio puede utilizarse como un tratamiento de segunda línea en pacientes de >12 años de edad que experimenten una crisis grave. Tras una mejoría, debería continuarse con el agonista ß2 de acción corta durante el período de observación y se debería aprovechar la oportunidad de educar al paciente o al padre acerca del uso de inhaladores o espaciadores y sobre los factores de riesgo y otros factores que podrían mejorar el control.
Dos de los aspectos del tratamiento que a menudo se pasan por alto son: el tiempo de recuperación y la prevención. La prevención puede centrarse en el mejor uso de la medicación, incluyendo el uso adecuado de los inhaladores, la adherencia al tratamiento, los efectos secundarios, el uso de espaciadores, el coste y la disponibilidad. La prevención sin medicación incluye la educación sobre factores de riesgo, sobre todo las infecciones respiratorias, mediante el lavado de manos, evitando el contacto con personas enfermas, reduciendo la contaminación en exterior e interior, mejorando la nutrición y haciendo ejercicio.
La comunidad médica cuenta con medicación efectiva, pautas efectivas basadas en la evidencia y una comunidad investigadora activa que colabora a nivel internacional. Sin embargo, carece de recursos, de tiempo para educar a los pacientes, del cumplimiento adecuado de las pautas por parte de los pacientes, de fórmulas para el control de la enfermedad, y factores de riesgo, estudios de cohorte locales y, lo más importante, una cura. Es necesario cubrir estas necesidades para que la comunidad médica pueda cumplir con sus responsabilidades hacia los pacientes.
Inmunomoduladores: ¿cuál es su rol en la prevención del desarrollo de asma y las exacerbaciones?
Muchos son los factores que pueden provocar una exacerbación del asma, desde los cambios de temperatura hasta los alérgenos, pasando por los contaminantes, el estrés, el ejercicio, las infecciones o el tabaco. Las medidas preventivas, como el uso de inmunomoduladores, podrían reducir la respuesta del sistema inmunológico hacia estos desencadenantes y, por tanto, el grado de la exacerbación.
Actualmente tenemos resultados prometedores de cinco estudios sobre el inmunomodulador OM-85 de lisado bacteriano que previene las sibilancias y el asma en la infancia. En un estudio pequeño, aleatorio y unicéntrico que se llevó a cabo en China, los niños hospitalizados por sibilancias que necesitaron oxígeno, glucocorticoides o tratamiento broncodilatador recibieron, de forma aleatoria, y tras el alta, OM-85 (n=24) (dosis estándar: 3,5 mg/día durante 10 días/mes durante tres meses) o dosis estándar o aerosol budesonide 200 µg una o dos veces al día (n=19). También se incluyeron, en el estudio, pacientes de control sin tratar y saludables (n=10). A lo largo del seguimiento realizado durante el primer año, se observó una reducción del 38 % en el riesgo de sibilancias recurrentes. Tras la administración de OM-85, solo un 25 % de los niños sufría de sibilancias recurrentes frente al 63 % que recibió esteroides inhalados (p<0,05).62
Se desarrolló en Turquía un estudio doble ciego, aleatorio, de grupo paralelo sobre el uso de OM-85 en pacientes de edades comprendidas entre 1 y 6 años, con sibilancias recurrentes provocadas por un virus. Setenta y cinco niños recibieron OM-85 o placebo (dosis estándar) con un seguimiento de un año. El OM-85 redujo el número de ataques de sibilancias en un 38 % en 12 meses (Figura 3) (diferencia media: 2,18; 95 % IC: 3,22–1,13; p<0,001) y la diferencia fue altamente significativa desde los 9 meses en adelante (p=0,001). En consonancia con la relación entre la infección y los episodios de sibilancias, el número de infecciones respiratorias agudas (ITR) (-2,44 [-3.5 o -1.36]; p<0,001) y los episodios de nasofaringitis (-2,11 [-2.94 to -1.27]; p<0,001) se redujo en los 12 meses, con una reducción altamente significativa desde los 6 meses en adelante para ambos trastornos (p<0,001). Los pacientes a los que se trató con OM-85 lograron, además, reducir el número acumulado de días con sibilancias por paciente y la duración de los ataques de sibilancias (p<0,001). Los autores concluyeron que el OM-85 es un tratamiento complementario útil para la reducción del número de ataques y la duración de los ataques de sibilancias inducidos por ITR en niños en edad preescolar.63 Hay que tener en cuenta las diferencias de fenotipo en las sibilancias en pacientes entre las edades de 1 y 6 años, que podrían influir en los resultados.
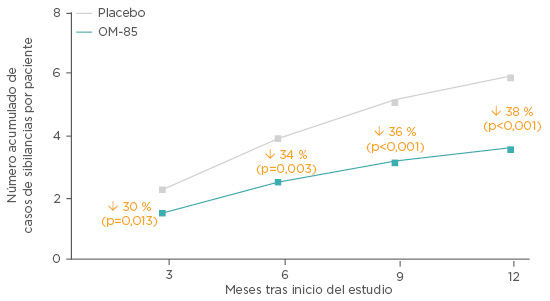
Figura 3: Efecto de la profilaxis de OM-85 en niños en edad preescolar con un historial de sibilancias virales recurrentes.
Adaptado de Razi et al.63
Un estudio de un año, unicéntrico, prospectivo y abierto comparó el OM-85 (n=29) con corticosteroides inhalados (n=16) en niños en edad escolar con asma en fase aguda. Se dejó a elección de los participantes el brazo de estudio, introduciendo un sesgo de selección. El OM-85 redujo las exacerbaciones asmáticas (reducción del 55 %) y las infecciones (reducción del 61 %). Se observó un efecto correctivo en el desequilibrio de citocina Th1/Th2 (INF-Y:IL-4) en ambos grupos de pacientes. La función pulmonar mejoró en el grupo de OM-85 frente a los pacientes tratados con ICS; sin embargo, estos resultados deberían interpretarse cuidadosamente ya que no se ajustaron por estatura, género o edad. 64
Un estudio prospectivo, aleatorio y doble ciego comparó la profilaxis de OM-85 (n=35) o el placebo (n=40) en niños en edades comprendidas entre 1 y 12 años con asma e ITR recurrente. El brazo activo recibió una dosis estándar de OM-85 en los meses 1–3, y, de nuevo, en los meses 7–9. Se observaron reducciones en el número de infecciones del tracto respiratorio (ITR) superior e inferior (ITRS e ITRI) en los 6 y los 12 meses en comparación con los valores iniciales (p<0,05) y con el placebo (p<0,01) (Figura 4). Además, se observaron aumentos de la ß–defensina-1 humana, IgA, e IgG en el suero del grupo de tratamiento frente a los valores iniciales en los meses 6 y 12 (p<0,05) y al grupo de placebo en los meses 6 y 12 (p<0,05).65
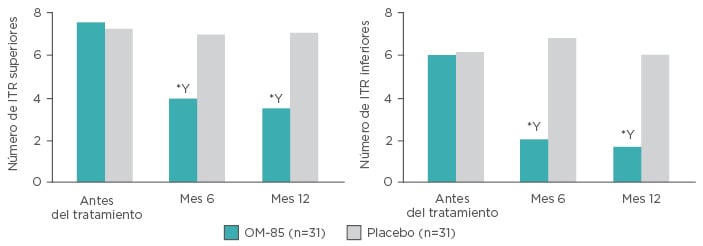
Figura 4: Número de infecciones del tracto respiratorio superior y de infecciones del tracto respiratorio inferior en pacientes a los que se administra profilaxis de OM-85 o placebo.
*p<0,01 (comparado con placebo); Үp<0,05 (comparado con antes del tratamiento).
ITR: infecciones del tracto respiratorio.
Adaptado de Liao y Zhang65
Un ensayo aleatorizado reciente comparó el OM-85 combinado con el tratamiento estándard (n=74) y el tratamiento estándard por sí solo (n=62) en lactantes con bronquitis capilar viral y asma secundaria. La incorporación de OM-85 al tratamiento de referencia dio como resultado una mejoría significativa de la bronquitis capilar y el asma 1 año después del tratamiento (Figura 5). Además, se observaron mejorías en los niveles de IL-17, IL-4, IL-10 e INF-Y en el grupo de OM-85.66
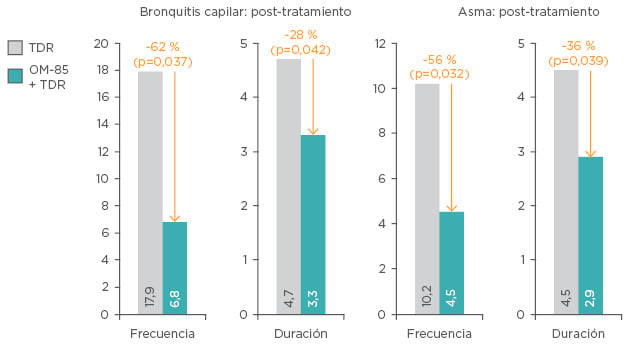
Figura 5: Frecuencia de bronquitis capilar y exacerbaciones del asma tras la incorporación de OM-85 en el tratamiento estándard frente al tratamiento estándard por sí solo.
TDR: tratamiento de referencia.
Adaptado de Han et al.66
Pacientes en situación de riesgo
Los pacientes en situación de riesgo por sibilancias que podrían ser considerados para la profilaxis de OM-85 incluyen a lactantes prematuros, niños de <6 meses, niños que no han sido lactantes, pacientes con un trastorno coronario o pulmonar subyacente (p. ej. fibrosis quística y síndrome de Down), niños con un sistema inmunológico deprimido, niños expuestos al humo del tabaco y niños expuestos a ambientes multitudinarios (p. ej. guarderías y hermanos). A medida que la vulnerabilidad fisiológica disminuye con la edad, la exposición aumenta, por lo que el riesgo de padecer bronquitis grave o sibilancias sigue siendo alto.
La hospitalización por infección VSR es bastante más común en niños prematuros (6−7 %) que en pacientes sanos (2−3 %). En el caso de los lactantes con enfermedad pulmonar crónica, podría llegar a darse una tasa de hospitalización cercana al 39 % durante el primer año de vida.67 Los niños con síndrome de Down están en situación de riesgo alto de hospitalización debido a las alteraciones en su estructura pulmonar. La prevalencia de hospitalización para este grupo es de, aproximadamente, el 10 % durante los primeros 2 años de vida.68
Los grupos en situación de riesgo de asma persistente son aquellos con un historial parental de asma (sobre todo maternal) y alergia; los que tienen eccema o rinitis alérgica; los que experimentan sibilancias persistentes, infección viral sin sibilancias o sibilancias inducidas por el ejercicio; los que se enfrentan a episodios graves de sibilancias; los pacientes con sensibilización alérgica, particularmente polisensibilización temprana; y aquellos que sufren un aumento en el número de eosinófilos y fracción exhalada de óxido nítrico.
OM-85: perspectivas futuras e investigación
A pesar de que lleva 35 años usándose en el entorno clínico, aún hay preguntas pendientes relativas al mecanismo del OM-85. Actualmente, no existen datos que hayan examinado las 21 cepas bacterianas contenidas en el OM-85 esenciales para su efecto inmumodulador, o si se requiere la presencia de todas las cepas. Los componentes bacterianos y los receptores específicos de reconocimiento, probablemente receptores de tipo Toll, que responden a los mismos aún han de ser identificados. Los estudios que comparan diferentes dosis o los programas de dosificación no se han llevado a cabo y no hay suficientes datos disponibles sobre si la actividad es igual en pacientes con sibilancias alérgicas o no alérgicas.
Actualmente hay cuatro estudios en desarrollo que investigan la relación del OM-85 con las sibilancias y el asma que podrían tratar las cuestiones anteriores. El estudio OMPAC,69 actualmente en desarrollo en Australia, incluye a 60 lactantes con edades comprendidas entre los 3-9 meses en riesgo debido a un hermano con asma o atopia. Este ensayo aleatorizado comparará los resultados en lactantes tratados con OM-85 en dos ciclos durante los dos primeros inviernos de los lactantes (3,5 mg; 10 dosis/5 meses consecutivos) frente al placebo. El estudio comparará la prevención principal de ITRI, desarrollo de asma persistente, microbiota nasal, linfocitos T reguladores circulantes, sensibilización a alérgenos y análisis del transcriptoma. Los resultados del OMPAC se esperan para junio de 2019.
El estudio ORBEX70 es un ensayo a gran escala, multicéntrico, aleatorizado, controlado con placebo, con más de 8 centros en los EE. UU. (N=1.076). El objetivo es determinar si el OM-85 (3,5 mg/día durante 10 días/mes durante 2 años) administrado a los lactantes (6-18 meses) en situación de riesgo por eccema atópico y/o por tener un padre/hermano con asma puede aumentar el tiempo de aparición del primer episodio de sibilancias, por enfermedad del tracto respiratorio inferior durante el tercer año de observación tras la terapia.
El criterio de exclusión incluye más de un episodio serio de sibilancias o más de dos episodios leves. Las sibilancias graves se caracterizan por la presencia de tos y sibilancias durante más de 24 horas y uno de los siguientes factores: >6 dosis de albuterol en menos de 48 horas, visitas a los servicios de urgencias u hospitalización, uso de corticosteroides inhalados o sistémicos, asma diagnosticada o una enfermedad sistémica (que no sea alergia). El resultado primario es el tiempo transcurrido hasta el primer episodio de sibilancias durante el seguimiento. Los resultados secundarios incluyen la frecuencia de las sibilancias durante el tratamiento y la monitorización, el tiempo transcurrido hasta el primer episodio de sibilancias durante el tratamiento y la frecuencia de las sibilancias graves durante el tratamiento. Se evaluarán los eventos adversos y se recopilarán muestras de ADN, suero y heces para su uso en futuros estudios genéticos que evalúen las floras bacteriana y viral. La selección se llevará a cabo desde enero de 2017 hasta diciembre de 2018, y se espera que los resultados preliminares salgan en diciembre de 2021. 70
El ensayo italiano OMPeR investigará el uso de OM-85 en la prevención de ITRS en niños de 1−5 años en riesgo de presentar inmunodeficiencia leve (IgA, IgG), atopia o sibilancias recurrentes. La administración de dosis estándar de OM-85 o placebo será aleatoria entre los niños, estratificados por factor de riesgo. Un brazo exploratorio adicional se encargará de investigar la dosificación de 10 días durante 6 meses consecutivos. La prevención de ITRS a lo largo de un período de monitorización de 6 meses será investigada junto con la duración y gravedad de la ITRS, el promedio de ITRI, las ITR que requieran del uso de antibióticos, la tonsilitis bacteriana, la otitis media aguda, los días de colegio perdidos, la terapia con antibióticos y los ciclos, y la microbiota fecal. Para los pacientes reclutados durante una infección activa en la primera visita, también se medirá el tiempo de curación. Los resultados se esperan para 2018 (Profesor S. Espósito, comunicación personal, 2017).
Finalmente, el estudio BREATHE71 tiene un objetivo alternativo de mejora del control del asma. Los adolescentes y los adultos jóvenes (12−40 años; N=120) con asma no controlada (GINA 4 y ≥2 exacerbaciones asmáticas durante la anterior temporada invernal, Cuestionario sobre control del asma >1,5) serán aleatorizados para recibir OM-85, a 7 mg/día durante 10 días consecutivos durante la temporada de virus que va de octubre a marzo durante dos estaciones consecutivas, o placebo. Tras el tratamiento, que tendrá un período de 18 meses, y que abarcará dos inviernos, se llevará a cabo un seguimiento de 1 año. La reducción de las exacerbaciones del asma, incluidas las que se sospecha que tienen origen viral, se evaluará junto a la presencia de marcadores en microbioma nasofaríngeo/fecal e inflamatorios en suero o esputo. Los resultados se esperan para 2020.71
Siguientes pasos
Dos grupos ya mencionados en riesgo, lactantes prematuros y lactantes con síndrome de Down, ofrecen oportunidades para la investigación de la supuesta necesidad clínica no satisfecha de profilaxis de OM-85. La escala de esta necesidad no satisfecha en Latinoamérica se ilustra en un cohorte de nacimiento longitudinal llevado a cabo en Brasil con lactantes prematuros (N=310), BREVI, que mostró unos índices extremadamente altos de ITRI (58 %) y ITRI grave (21 %), un 61 % de las cuales se relacionó con VSR.72 Dado el gran número de lactantes hospitalizados por VSR, (n=56), la investigación de la supuesta capacidad que el OM-85 tiene de reducir las hospitalizaciones en esta población debería ser prioritaria.
CONCLUSIÓN
La prevalencia del asma aumenta a nivel mundial y está asociada a efectos económicos y humanitarios sustanciales. Las infecciones virales son importantes en el desarrollo y la exacerbación del asma, junto con una compleja interacción entre los genes y el entorno. Las ITR no pueden evitarse totalmente y el contacto con microorganismos es una necesidad para la maduración del sistema inmunitario. Sin embargo, los inmunomoduladores ofrecen un mecanismo de protección doble a través de la creación de un estado inmune pre-alerta que reduce la tasa de infección y de la reducción del exceso de los procesos inflamatorios. El inmunomodulador OM-85 reduce las ITRS, ITRI y las sibilancias en niños y se están desarrollando estudios que investigan el efecto del OM-85 en la prevención del asma en niños en situación de alto riesgo.








