Meeting Summary
El tercer Encuentro Latinoamericano de Infecciones Respiratorias Recurrentes (ELAIR) tuvo lugar en Ciudad de México (México), los días 11 y 12 de mayo de 2017. ELAIR reunió a expertos de toda Latinoamérica y otros países, en la continuación de su extraordinario ejercicio didáctico acerca de los últimos avances en medicina respiratoria. En los últimos 15 años se ha progresado de modo espectacular en el tratamiento y la prevención de las infecciones de las vías respiratorias, gracias a la aparición de nuevos tratamientos. Queda por ver cómo podría afectar todo esto a los trastornos relacionados de sibilancias y asma en las personas predispuestas e hipersensibles. No obstante, los datos iniciales indican que unas tasas más bajas de infección en las vías respiratorias podrían reducir la aparición de los trastornos antes mencionados, que están íntimamente relacionados con las infecciones víricas. Es probable que los inmunomoduladores que preparan el sistema inmunológico para combatir las infecciones y reducen la inflamación desempeñen una función fundamental en la prevención secundaria (e incluso, posiblemente primaria) de las enfermedades atópicas.
This article has a correction, made on 09.01.18.
The details of the correction are as follows: The word ‘Racional’ was edited to read ‘Razón Fundamental’ in the last paragraph heading on pg.18.
The prior version of the paper is available on request, please contact [email protected]
CONCEPTOS BÁSICOS EN EL FUNCIONAMIENTO DEL SISTEMA INMUNITARIO
Desarrollo del sistema inmunitario
Al igual que otros sistemas orgánicos, como el sistema circulatorio o el respiratorio, el sistema inmunitario es fundamental para la vida humana. Los órganos del sistema inmunitario gestionan nuestra interacción con el entorno formando barreras protectoras cuando es necesario y ofreciendo defensa, tanto activa como pasiva, contra posibles atacantes.
La complejidad del sistema inmunitario humano refleja una carrera armamentística evolutiva de adaptación y contraadaptación que empezó hace 4000 millones de años con las sencillas defensas bioquímicas de los organismos unicelulares. Las esponjas y corales multicelulares desarrollaron la capacidad clave de autorreconocimiento y de su falta hace aproximadamente 1500 millones de años; más tarde, en los celomatos prevertebrados que existieron hace 600 millones de años, los espacios intercelulares especializados generaron unas células específicamente adaptadas, entre ellas las células inmunitarias con capacidad para la fagocitosis, una estrategia que habían utilizado con anterioridad los organismos unicelulares para su alimentación. En la misma era aparecieron los péptidos antimicrobianos (PAM) y los receptores de reconocimiento de patrones (RRP), que mejoraron su falta de autorreconocimiento. Hace 400 millones de años, los polimorfismos del complejo principal de histocompatibilidad (MHC) permitieron un gran salto hacia adelante en la especificidad inmunitaria y allanaron así el camino a la inmunidad adaptativa y la aparición de las inmunoglobulinas (Ig) contra antígenos específicos en los reptiles. Por último, la Ig se diversificó en diversos subtipos con funciones específicas y hace unos 200 millones de años aparecieron los subtipos de Ig que se encuentran actualmente en las especies mamíferas.
La evolución a nivel de especie del sistema inmunitario impulsada por los cambios genéticos se refleja en un microcosmos mediante la evolución ontogénica de la inmunidad particular de cada persona. La maduración inmunitaria ontogénica se produce mediante cambios epigenéticos tanto en el útero como durante la vida. De hecho, antes incluso de la fertilización, el esperma utiliza potentes estrategias de tolerancia inmunitaria para evadir el sistema inmunitario de la hembra y permitir así la formación del cigoto; de igual forma, el sistema inmunitario de la madre debe desarrollar mecanismos de tolerancia para los aloantígenos en el cigoto y el feto resultantes. Durante y después del parto, el bebé se verá expuesto a una multitud de antígenos durante un periodo rápido, cuya naturaleza afectará a la maduración del sistema inmunitario. El tipo de parto, bien sea vaginal o por cesárea, cambia la exposición a la microbiota y, por tanto, modifica el sistema inmunitario, que también se ve influido por el microbioma en desarrollo del bebé el cual, a su vez, influye en gran medida sobre el desarrollo del sistema inmunitario.1 Además del conocido efecto directo del calostro sobre la inmunidad del recién nacido, la lactancia materna también modifica la microbiota del bebé. Los bebés amamantados presentan un microbioma intestinal más diverso, lo que a su vez ayuda tanto al desarrollo inmunitario como a la homeostasis. Este efecto homeostático del microbioma intestinal se prolonga durante toda la vida y convierte en factores importantes para el mantenimiento de la salud del sistema inmunitario el mantenimiento de la diversidad y la evitación de los factores dañinos, como el uso excesivo de los antibióticos.
Los cambios epigenéticos continúan durante la infancia y el sistema inmunitario alcanza su máximo funcional en los adultos jóvenes. Después de la maduración, los principales acontecimientos que alteran las funciones en el sistema inmunitario incluyen la inmunotolerancia reproductiva antes mencionada y la inmunosenescencia (que se define como el proceso de envejecimiento del sistema inmunitario). La inmunosenescencia aumenta el riesgo de infección y la pérdida del control de los procesos inflamatorios, lo cual puede generar predisposición a sufrir afecciones cardíacas, accidentes cerebrovasculares, enfermedad de Alzheimer e incluso algunas formas de neoplasia. Además, la autoinmunidad aumenta con la edad, lo cual provoca un riesgo adicional de trastornos como artritis reumatoide, miastenia grave y diabetes. Para poner en contexto este riesgo, se calcula que los riesgos durante toda la vida de padecer cáncer y enfermedades autoinmunitarias en los países desarrollados son del 30 % y del 10 %, respectivamente.
Estructura y funcionamiento del sistema inmunitario
Aunque el control de las infecciones es una función clave del sistema inmunitario, esta no es su única finalidad. La reparación de los tejidos y la eliminación de las células dañadas o neoplásicas también son funciones fundamentales de este sistema. Otra de sus tareas cruciales es apoyar el desarrollo del microbioma intestinal, lo que a su vez respalda el funcionamiento inmunitario correcto. Estas funciones tan dispares son interdependientes, según ilustra la reparación de los tejidos después de una inflamación asociada con el sistema inmunitario o la eliminación de las células infectadas por los virus, y la actividad armoniosa de estas funciones es crucial para el adecuado funcionamiento inmunitario. Al igual que numerosos órganos y sistemas, la función principal del sistema inmunitario es adaptarse para mantener la homeostasis en un entorno en constante fluctuación. Es muy probable que este imperativo de adaptación sea la razón oculta tras la conservación de las numerosas estrategias inmunológicas desarrolladas durante el proceso evolutivo.
La conversación sobre la inmunidad con frecuencia se centra en las respuestas innatas y adaptativas, y pasa por alto la inmunidad constitutiva, que comporta igual importancia. La inmunidad constitutiva es independiente de los estímulos y consta principalmente de barreras, mientras que la inmunidad innata y la adaptativa dependen de las respuestas a los estímulos. El sistema innato se caracteriza por una respuesta rápida, aunque inespecífica, mientras que el sistema adaptativo actúa con mayor lentitud, aunque con una respuesta más específica y eficaz que confiere inmunidad a largo plazo. La inmunidad constitutiva incluye las barreras epiteliales (como la piel, el transporte mucociliar, el PAM natural y las enzimas antimicrobianas, como las lisozimas). La inmunidad innata comprende las células linfáticas innatas (CLI), el complemento, los mastocitos, los neutrófilos, los eosinófilos y los basófilos. Las principales células efectoras del sistema inmunitario adaptativo son los múltiples subtipos de linfocitos T y B (estos últimos producen la Ig). Como ocurre con las funciones del sistema inmunitario, las clases de inmunidad son interdependientes y se superponen. La inmunidad innata y la adaptativa deben funcionar al unísono con distintas células detectoras y efectoras, de forma que trabajen de forma concertada y con armonía, a la manera de músicos en una sinfonía celular. Algunos tipos de células pasan de un tipo a otro y desempeñan una función doble en ambos modos de inmunidad.
Inmunidad constitutiva
Las uniones ocluyentes entre las células de las distintas barreras epiteliales del cuerpo protegen contra el paso de virus, bacterias, hongos y alérgenos. La producción de moco por parte de las células caliciformes y el movimiento coordinado de los cilios facilitan el sistema de transporte mucociliar e impiden aún más la entrada de patógenos y alérgenos, además de ayudar a expulsarlos. Una cantidad de humedad suficiente, una temperatura correcta y una viscosidad adecuada de la mucosa son todos factores clave para el funcionamiento del sistema de transporte mucociliar.
Los PAM son proteínas antiinfecciosas, fabricadas en las barreras constitutivas y activas contra las bacterias tanto grampositivas como gramnegativas; además, los PAM pueden atacar la envoltura vírica, los hongos, los protozoos e incluso las células cancerosas. Los PAM también desempeñan una función inmunorreguladora y generan un efecto quimiotáctico que ayuda a reducir la respuesta inflamatoria y facilita su desaparición, al tiempo que modera e interactúa con la respuesta inmunitaria adaptativa. Los PAM también contribuyen a regular la microbiota y funcionan mediante dos mecanismos principales: la formación de poros transmembranales, con efecto citolítico, y la penetración de la membrana celular y perturbación de los procesos esenciales mediante la unión a las moléculas intracelulares.
Inmunidad innata
La activación de los RRP es una fase primaria en el inicio de la respuesta inmunitaria innata. Existen diversos tipos de RRP; no obstante, los receptores de tipo Toll (TLR) de expresión externa son uno de los más importantes. Los TLR reconocen productos conocidos como patrones moleculares asociados a patógenos (PAMP) e inician una respuesta rápida. Tras la activación, las cascadas internas de transducción de señales que implican MyD88 y Trif dan lugar a la liberación de las citocinas proinflamatorias. Estas citocinas activan a su vez los neutrófilos y macrófagos, que eliminan los patógenos.
Los neutrófilos activados se moverán hacia el patógeno mediante mecanismos quimiotácticos antes de adherir a él, realizar su endocitosis o digerirlo por medio del proceso de fagocitosis. Los neutrófilos también combaten las infecciones mediante la liberación de compuestos antimicrobianos, a través del proceso conocido como degranulación. La táctica antimicrobiana final de los neutrófilos es la liberación de las trampas extracelulares de neutrófilos (NET), formadas por redes de ADN que contienen productos antimicrobianos y atrapan los microbios de manera que forman una barrera física, especialmente en la sangre. Las NET pueden liberarse mientras el neutrófilo continúa funcionando o en el momento de la muerte de la célula por lisis en una forma controlada de apoptosis, conocida como NETosis. Las NET liberadas por el sacrificio de los neutrófilos no solo atrapan patógenos y toxinas, sino que también promueven su eliminación y la reparación de los tejidos. En comparación, los macrófagos son células más sencillas, que dependen de la fagocitosis para atrapar microorganismos antes de fusionar sus fagosomas a modo de cárcel con los lisosomas para crear fagolisosomas donde se digieren los microorganismos. Sin embargo, incluso estas células más sencillas desempeñan otras funciones metabólicas en la inmunidad innata.
Los linfocitos citolíticos asesinas naturales (NK, del inglés natural killer) supervisan las células de forma activa, comprueban si hay alguna molécula ubicua a lo largo de la molécula MHC de clase I y destruyen todas las células que carecen de este interruptor molecular. Tanto la infección vírica como los procesos neoplásicos pueden dar lugar a la pérdida de la MHC de clase I. Los linfocitos NK forman el grupo celular CLI-1, junto con las células CLI-2 que ayudan a controlar los patógenos extracelulares y las células CLI-3 que desempeñan una función en la inflamación, la defensa antimicrobiana contra hongos y bacterias, y la homeostasis tisular. Las CLI (Célula Linfoide Innata) se encuentran cerca de las barreras epiteliales y parecen desempeñar una función en el mantenimiento de la función de barrera; la disfunción de las CLI se ha relacionado con los trastornos alérgicos asociados con el epitelio, como el asma o la psoriasis.
Las CLI se relacionan, filogénica y funcionalmente, con las células del sistema inmunitario adaptativo, dado que comparten las mismas células precursoras y funciones en la lucha contra las infecciones. Los linfocitos T colaboradores (Th)2 se relacionan funcionalmente con el grupo CLI-2, y los Th22 y Th17 con el grupo CLI-3, mientras que los linfocitos Th1 se relacionan con el grupo CLI-1, que también contiene linfocitos NK. La característica que diferencia las células innatas de las adaptativas es la expresión de los receptores específicos de antígenos por los grupos de linfocitos Th.
Sistema inmunitario adaptativo
Las dos clases principales de células efectoras en el sistema inmunitario adaptativo son los linfocitos T y B. Los linfocitos T activan una respuesta citotóxica específica relativamente rápida, mientras que los linfocitos B se multiplican y producen Ig para combatir la infección. La activación de los linfocitos T empieza con las células dendríticas, un tipo de macrófago especializado que presenta antígenos junto con la MHC de clase II y las moléculas de coestimulación. Las células dendríticas presentadoras de antígenos primero fagocitan los patógenos antes de acoplar sus antígenos a la MHC II. Entonces se activan los linfocitos T, que reconocen el antígeno y generan una respuesta adaptativa.
Dada su especificidad antigénica, los linfocitos T indiferenciados pasan muchas horas moviéndose dentro y entre los ganglios linfáticos, escaneando células dendríticas y buscando su ligando antigénico.2 Los linfocitos T citotóxicos activados por las células dendríticas se dirigen directamente contra las células infectadas por virus o neoplásicas, mientras que los linfocitos Th activados reclutan y atraen más linfocitos mediante la liberación de citocinas. A la respuesta rápida inicial de los linfocitos T efectores, lo cual confiere protección inmediata, le sigue una respuesta más lenta del linfocito T de memoria, que protege frente al ataque del mismo patógeno en el futuro.
Los diferentes tipos de linfocitos Th liberan citocinas distintas y activan diferentes células efectoras. Los linfocitos Th1 reclutan linfocitos T citotóxicos, linfocitos B con IgG y macrófagos, que defienden principalmente contra los microorganismos intracelulares. En comparación, los linfocitos Th2 reclutan eosinófilos, mastocitos y linfocitos B portadores de IgG, IgA e IgE, en defensa contra los patógenos extracelulares, como los parásitos, y para regular la respuesta alérgica. La cascada de las citocinas Th1 inhibe la actividad de las Th2 y viceversa. Otro subtipo importante de linfocito Th es el Th17, que desempeña una función crucial en la inflamación tisular, la autoinmunidad y la defensa contra los patógenos extracelulares.
Al igual que el sistema inmunitario, los linfocitos Th deben permanecer en equilibro, y los linfocitos T reguladores (Treg) desempeñan una función destacada en el mantenimiento de este. Cuando se activa una respuesta inmunitaria específica, es posible que un tipo de Th domine el panorama inmunitario para reprimir una forma particular de infección, y los linfocitos Treg restauran el equilibrio tras la desaparición de la respuesta inmunitaria. Además de controlar el exceso de actividad, las células inmunitarias reguladoras controlan la migración de las células efectoras desde el tejido linfático a la mucosa, donde finaliza la defensa contra los patógenos invasores. El desequilibrio persistente en las poblaciones de linfocitos Th se asocia con las enfermedades autoinmunitarias.
Los linfocitos B son el otro tipo principal de célula efectora del sistema inmunitario adaptativo, con la función crucial de producir anticuerpos. La respuesta más común de los anticuerpos se produce a través de una vía dependiente de los linfocitos T, en la que los que residen en el centro germinal de los folículos linfáticos se activan mediante los linfocitos Th foliculares. Los linfocitos B activados se multiplican y con frecuencia se diferencian en blastocitos plasmáticos que producen IgM para obtener una respuesta rápida, aunque de afinidad débil, de Ig. El siguiente paso en la respuesta de los anticuerpos implica la diferenciación en células plasmáticas longevas, una rápida multiplicación y la maduración de la afinidad, que mejora la afinidad de los anticuerpos que se producen. En esta fase también se produce el cambio de los isotipos de los anticuerpos como, por ejemplo, entre los anticuerpos de tipo IgM e IgG. Los distintos tipos de Ig se especializan en diversas funciones; por ejemplo: la IgE se especializa en la defensa contra los patógenos parasitarios, mientras que la IgA actúa en la mucosa, donde se libera y se une entonces a un componente secretor que permite una actividad prolongada en el duro entorno proteolítico. Después de la respuesta inicial de los anticuerpos, se fabricarán linfocitos B de memoria, que conferirán inmunidad a largo plazo. Es importante tener en cuenta que las fases de inmunidad de efectores y de memoria no se limitan a los linfocitos T y B. Estas fases se reflejan en las clases de células reguladoras que previenen el exceso de actividad inmunitaria, con células reguladoras de memoria que persisten durante largo tiempo y que esperan la activación por parte de los antígenos junto con los linfocitos T y B de memoria.
Atopia y alergia
Son muchos los factores predisponentes que provocan una respuesta alérgica, y tanto la predisposición genética como los cambios epigenéticos pueden desempeñar una función destacada. También es posible que participen la alimentación, el microbioma y los factores medioambientales, como la contaminación. La disfunción en el entorno de los Treg puede dar lugar a un desequilibrio en las poblaciones de Th, lo cual contribuye a una respuesta alérgica. La predisposición genética a generar IgE en respuesta a los alérgenos habituales se conoce como atopia. Para que se produzca una alergia, la atopia debe combinarse con la sensibilización por un alérgeno, a la que sigue la hipersensibilidad que implica un control regulador inadecuado de la respuesta contra el alérgeno. La fase final inflamatoria de la respuesta alérgica es la que los pacientes reconocen como reacción alérgica, e implica la presentación sintomática de trastornos alérgicos tales como el eccema atópico, la rinitis alérgica y el asma alérgico.
Razón fundamental del uso de la profilaxis inmunomoduladora en la práctica clínica diaria
Las infecciones en las vías respiratorias (IVR) se han convertido en una prioridad clínica dada la gran carga social y personal asociada a la enfermedad.3,4 Su efecto es especialmente grave cuando se combina con trastornos crónicos graves: más de tres cuartos (78 %) de los casos de agravamiento de la bronquitis crónica y de la enfermedad pulmonar obstructiva crónica (EPOC) se deben a las IVR.5 El tratamiento de las IVR se dirige principalmente al alivio de los síntomas, mediante el uso de agentes como los fármacos antinflamatorios no esteroideos (AINE) para controlar la fiebre y la inflamación; sin embargo, pueden usarse antibióticos para combatir directamente la infección cuando los agentes causales son bacterias.
Los virus provocan más del 80 % de las IVR; no obstante, la presión del paciente y de las familias puede hacer que tanto médicos como farmacéuticos receten antibióticos cuando no hay pruebas de infección bacteriana.6,7 Este uso excesivo de antibióticos ha contribuido a crear la resistencia antimicrobiana y, por consiguiente, la disminución global del uso de los antibióticos es una prioridad urgente. En este contexto, el uso de antibióticos profilácticos debería limitarse a circunstancias excepcionales, como en pacientes con inmunodeficiencia primaria o fracaso del sistema inmunitario como, por ejemplo, en pacientes infectados por el VIH. La resistencia antimicrobiana aumenta la urgencia de la necesidad de estrategias profilácticas. Las medidas preventivas contra las IVR incluyen la educación, las intervenciones médicas o quirúrgicas y la inmunomodulación, tanto específica como inespecífica.
Prevención de las infecciones de las vías respiratorias
Las intervenciones conductuales pueden resultar eficaces en la reducción de las tasas de infección por medio del enfoque en la educación parental, la promoción de la lactancia materna y la reducción de los factores de riesgo modificables, como el tabaquismo, en las poblaciones de adultos de riesgo elevado.8,9 Otros factores de riesgo modificables que pueden orientar las campañas sanitarias públicas incluyen la exposición a sustancias contaminantes, evitar el hacinamiento y el tratamiento de las comorbilidades.10-13
En el caso de determinadas afecciones, las intervenciones médicas dirigidas, como las vacunas, desempeñan una función importante y se recomiendan encarecidamente cuando se dispone de ellas.14-16 Lamentablemente, no se dispone de vacunas contra la mayoría de los patógenos responsables de las IVR habituales.17 Las intervenciones quirúrgicas, como la amigdalectomía, probablemente continuarán utilizándose en la prevención de algunas infecciones recurrentes específicas, pero deberían seguir siendo el último recurso.
La inmunomodulación inespecífica es un enfoque que lleva utilizándose mucho tiempo para la prevención de las IVR y cuya importancia está en aumento en la actualidad. El enfoque inespecífico refuerza la capacidad general del sistema inmunitario de luchar contra las infecciones. Se han esarrollado diversos tipos de inmunomoduladores, como algunas sustancias fitoterapéuticas, lisados de bacterias, preparados ribosómicos bacterianos, derivados tímicos, péptidos sintéticos y sustancias químicas.18 La calidad de las pruebas para los inmunomoduladores varía significativamente; por ejemplo, a pesar de su uso desde los años 20, todavía no hay prueba alguna del beneficio clínico de la equinácea en el tratamiento de la rinosinusitis.19 Los datos extraídos de la respetada colaboración de Cochrane indican que los inmunomoduladores basados en extractos de las bacterias que suelen causar las IVR son los que tienen la base de evidencia más sólida.20-23 Además, los inmunomoduladores de lisados de bacterias llevan más de 30 años utilizándose en Europa.
INMUNOMODULADORES BACTERIANOS: MODO DE ACCIÓN
Los lisados de bacterias contienen PAMP y otros antígenos capaces de activar el sistema inmunitario innato y el adaptativo (Figura 1). Las células M situadas en la mucosa intestinal transportan antígenos a las células dentríticas especializadas presentadoras de antígenos y a los macrófagos. Los procesos de estas células dendríticas también se infiltran en la barrera de la mucosa, permitiendo el atrapamiento directo de los antígenos, y los TLR expresados por las células del epitelio intestinal también pueden activarse mediante la administración de lisados de bacterias por vía oral.24 Tal como se indicó con anterioridad, las células dendríticas son importantes para la activación de los linfocitos T, incluyendo los linfocitos Treg, que a su vez activan los linfocitos B que permiten la producción de IgA, la Ig secretora clave del sistema mucoso (Figura 1).24 Además, la mejora de la actividad de la IgA secretora en las mucosas deriva del componente secretor que protege el anticuerpo de la degradación producida por las enzimas proteolíticas en la mucosa. Tras la detección de los PAMP derivados de los lisados de bacterias, el sistema inmunitario de la mucosa permite la propagación de estas actividades inmunitarias derivadas del intestino a los ganglios linfáticos en el mesenterio y el tórax, distribuyendo la actividad antimicrobiana a otras mucosas.25
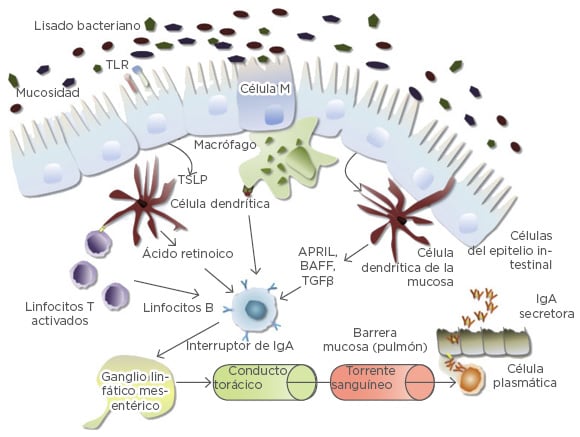
Figura 1: Activación del sistema inmunológico mediante lisados de bacterias por vía oral.
Por sus siglas en inglés: APRIL: ligando inductor de multiplicación; BAFF: factor de activación de los linfocitos B; IgA: inmunoglobulina A; TGFβ: factor de crecimiento transformante beta; TLR: receptor de tipo Toll; TSLP: linfopoyetina del estroma tímico.
Adaptado de Pfefferle et al.24
La inmunomodulación por los lisados bacterianos implica tanto la inducción de las células efectoras del sistema inmunitario como la activación de las clases de células inmunomoduladoras. Este efecto refleja el de la microbiota comensal, que estimula tanto la maduración del sistema inmune como reduce la sensibilización alérgica. Los inmunormoduladores de lisados de bacterias inducen las células inmunitarias efectoras (por lo que se reduce la infección) y activan las células inmunomoduladoras (con lo que se disminuye la inflamación). Las pruebas de los ensayos in vitro, in vivo y en seres humanos indican que los efectos inmunomoduladores de los lisados de bacterias inducen las células efectoras en el sistema inmunitario innato y adaptativo, así como en sus respectivas poblaciones de células dendríticas reguladoras y linfocitos T y B reguladores.26 Gran parte de la respuesta inmunomoduladora depende de los TLR antes mencionados, expresados en células epiteliales, células dendríticas, macrófagos, monocitos y linfocitos T y B. El tipo de TLR que se activa determina la actividad resultante; la producción de citocinas eleva la respuesta inflamatoria contra los patógenos, las quimiocinas atraen las células al lugar de la infección y las citocinas reguladoras, como la interleucina (IL)-10, ayudan a controlar la inflamación.26
La respuesta innata implica la activación sinergística de TLR-4, TLR-2/6, TLR-9 y TLR-7/8. Los TLR-4 y 9 son los que se han estudiado más ampliamente y las pruebas demuestran que los TLR-9 pueden participar en la inmunorregulación. Las quimiocinas CXCL-1, CXCL-6 y CXCL-8 atraen a los neutrófilos que ayudan a luchar contra las bacterias, y la activación de los linfocitos del grupo CLI-1 citotóxicos mejora la respuesta tanto antibacteriana como antivírica. Las citocinas proinflamatorias y antivíricas inducidas por inmunomoduladores tales como el OM-85, como parte de la respuesta innata, incluyen IL-1β, IL-6 y el factor de necrosis tumoral α, e IL-12, interferón (IFN)-α, IFN-β, IFN-γ, respectivamente.26
Los inmunomoduladores de lisados de bacterias también inducen las citocinas relacionadas con el sistema inmunitario adaptativo, incluyendo las citocinas IL-10 activadoras de los linfocitos B, el factor activador de los linfocitos B (BAFF) y la IL-6. Se ha demostrado la activación por inmunomoduladores de las clases de linfocitos Th y B adaptativos, al igual que la cascada de respuesta de Ig de producción rápida de IgM, seguida de IgG e IgA. Junto con la IgA, que es fundamental para la respuesta inmunitaria de la mucosa, la IgG tiene la ventaja de contar con una distribución más amplia y de ofrecer una respuesta humoral de memoria más larga.26
Los efectos de inmunorregulación de los inmunomoduladores de lisados de bacterias implican la maduración de las células dendríticas tanto plasmocitoides como mieloides, que se indica mediante la presencia de las proteínas reguladoras de los linfocitos T CD80 y CD86. Se ha demostrado la activación de CCR7, que resulta clave para la migración de las células dendríticas a los ganglios linfáticos mesentéricos, y también se ha comprobado in vitro la activación de las células CD4+ CD25+ FOXP3+ Treg relacionadas con los lisados de bacterias. Existen diversas subpoblaciones de dichos reguladores, como el Treg 1, que produce principalmente IL-10, y las células Th3 que producen el factor transformador del crecimiento beta (TGF-β). La IL-10 es muy importante para la producción de anticuerpos y para el control de la inflamación, mientras que el TGF-β resulta necesario para la maduración de los linfocitos y la producción de IgA. La expresión celular reguladora del receptor de quimiocinas CCR9, que ayuda a las células a migrar hacia las mucosas, también se ve aumentada por los inmunomoduladores.26,27
Datos mecanísticos para el inmunomodulador de lisados de bacterias OM-85
El OM-85 es el inmunomodulador de lisados de bacterias más estudiado.20 Los datos de Navarro et al.27 demuestran la activación por OM-85 de las células dendríticas en la mucosa intestinal, lo que da lugar a la presentación de los antígenos y a la maduración de los linfocitos T a linfocitos Th2 en un modelo murino. Estos linfocitos Th2 respaldan a los linfocitos B en la producción de IgA secretora, antes de que se produzca la migración a la mucosa de las vías respiratorias, donde siguen produciendo IgA secretora, así como TGF-β. Junto con las funciones antes mencionadas, el TGF-β contribuye a la reparación tisular mediante la activación de los fibroblastos. El modelo de inmunomodulador doble proinmunitario/antinflamatorio queda ejemplificado por la producción relacionada con los linfocitos T reguladores de tipo 1 de IL-10 antinflamatoria, provocada por OM-85.27 Estos datos en ratones se han reproducido en pacientes con neumopatía obstructiva crónica, en quienes OM-85 provocó un aumento sinergístico de la producción de IL-10 en condiciones proinflamatorias.28 OM-85 también actúa de manera moduladora en los ensamblajes moleculares, conocidos como inflamasomas (o inflamosomas), cuya importancia como iniciadores clave de la inflamación está aumentando. Los inflamasomas son conjuntos de moléculas que se ensamblan dentro de la célula como respuesta a las infecciones, los daños tisulares o los desequilibrios metabólicos, con el fin de activar las principales citocinas inflamatorias, IL-1β e IL-18, entre otras. El ensamblaje de inflamasomas depende principalmente de tres clases de moléculas: una molécula sensora, una proteína adaptadora y la caspasa 1. En la mayoría de los inflamasomas descritos en la actualidad, las moléculas sensoriales son receptores de tipo NOD, un RRP relacionado con los TLR, pero situado dentro del citoplasma, en lugar de en la superficie celular. Los receptores de tipo NOD desencadenan la formación de inflamasomas, donde se ensamblan junto con proteínas adaptadoras y de la procaspasa 1. La formación de inflamasomas da lugar a la conversión de la procaspasa 1 a caspasa-1 activada. Las actividades posteriores de proteasa de la caspasa-1 dan lugar, a continuación, a la fragmentación de los precursores de IL-1β e IL-18, así como de su subsiguiente activación (Figura 2).
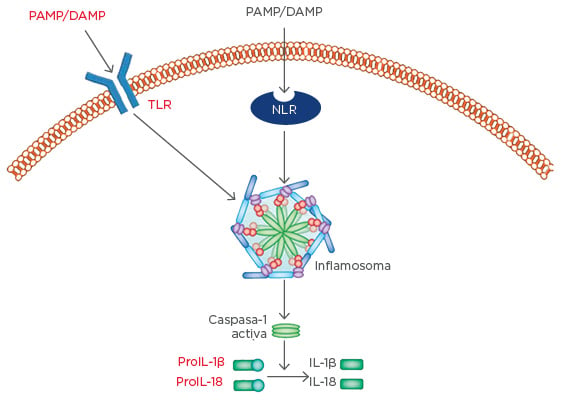
Figura 2: La formación de inflamasomas da lugar a la activación de las citocinas inflamatorias.
Por sus siglas en inglés: DAMP: patrones moleculares asociados con el daño; IL: interleucina; PAMP: patrones moleculares asociados a los patógenos; NLR: receptor de tipo NOD; TLR: receptor de tipo Toll.
Adaptado de Shao et al.29
En un estudio reciente, la incubación de células dendríticas con OM-85 indujo a un estado preactivado en dos inflamasomas importantes en las enfermedades víricas de las vías respiratorias, sin aumento de los niveles de procaspasa. Los autores indicaron que este estado activado podría ayudar en la respuesta inflamatoria después de una infección vírica. En línea con esta hipótesis, la producción de IFN-β antivírico también se demostró en las células dendríticas a través de la estimulación inducida mediante OM-85 de los TLR Trif y MyD88 antes mencionados. OM-85 provocó también la disminución de la liberación de la citocina IL-1β inflamatoria y dependiente del inflamosoma, y redujo la actividad neutrófila, eosinófila y macrófaga en un modelo de infección bacteriana que utilizó la exposición a lipopolisacáridos y el alumbre complementario.30
CONCLUSIÓN
El sistema inmunitario funcional protege contra las infecciones, a la vez que mantiene la homeostasis en un entorno fluctuante. Las pruebas mecanísticas indican que los inmunomoduladores de lisados de bacterias, como el OM-85, respaldan la homeostasis inmunitaria y ayudan a luchar contra las infecciones por medio de la inducción de una respuesta inmunitaria, la creación de un estado inflamatorio de pre-alerta y la reducción concurrente de la inflamación.