Meeting Summary
El tercer Encuentro Latinoamericano de Infecciones Respiratorias Recurrentes (ELAIR) tuvo lugar en Ciudad de México, México, los días 11 y 12 de mayo de 2017. ELAIR reunió a expertos de toda Latinoamérica y otros países, continuando con un extraordinario ejercicio didáctico sobre los vanguardistas avances de la medicina respiratoria. En los últimos 15 años, se ha logrado un progreso espectacular, gracias a la aparición de nuevos tratamientos disponibles para gestionar y evitar infecciones en las vías respiratorias. Queda por ver cómo podría afectar todo esto a las afecciones relacionadas de las sibilancias y el asma en los sujetos predispuestos e hipersensibles. No obstante, los primeros datos sugieren que las tasas más bajas de infección en las vías respiratorias podrían reducir el desarrollo de las afecciones antes mencionadas y estrechamente relacionadas con las infecciones víricas. Es probable que los inmunorreguladores que preparan el sistema inmunitario para combatir la infección y que además reducen la inflamación jueguen un papel fundamental en la prevención secundaria (e incluso potencialmente primaria) de las enfermedades atópicas.
INFECCIONES RECURRENTES Y CRÓNICAS DE LAS VÍAS RESPIRATORIAS EN ADULTOS: CARGA DE LA ENFERMEDAD
Las infecciones de las vías respiratorias superiores (IVRS) tienen un impacto social significativo como principal causa de las visitas al médico y del absentismo laboral en los adultos. En los países desarrollados, las infecciones en las vías respiratorias (IVR) agudas contabilizan el 20 % de todas las consultas médicas y el 75 % de todas las recetas de antibiótico.1 La carga económica de las infecciones respiratorias es considerable, y las cifras del año 2002 sugieren que en EE. UU. se gastaron más de 2000 millones de USD en medicación sin receta médica, y que para el Servicio Nacional de Salud (NHS) del Reino Unido, el coste anual de las infecciones de las vías respiratorias superiores se elevó a unos 60 millones de GBP.2
Las patologías de las vías respiratorias tienen los mismos nombres para niños y para adultos, a pesar de que la presentación en los sistemas respiratorios e inmunitario en desarrollo frente a los totalmente desarrollados puede resultar sustancialmente diferente. La rinosinusitis crónica (RSC) es una afección que se produce con frecuencia en los adultos, y se define como una persistencia de la inflamación sinusal superior a 3 meses. Los síntomas incluyen obstrucción nasal, congestión, rinorrea, descarga anterior, goteo posterior y dolor facial. Los síntomas secundarios son dolores de cabeza, presión facial, dolor de oídos, halitosis, tos, dolor dental, fiebre y fatiga. Dada su persistencia, el impacto en la calidad de vida (CdV) del paciente podría ser significativo.
La RSC afecta aproximadamente al 11 % de la población de toda Europa, y al 14 % de la población estadounidense.3-6 Los individuos que sufren tanto de la enfermedad aguda como de la RSC muestran siempre una puntuación inferior a la de la población general en aspectos tanto físicos como emocionales relacionados con la CdV, según la evaluación realizada por el SF-36 (cuestionario de salud corto de 36 elementos) (Figura 1).7,8 Teniendo en cuenta el impacto de los factores sociales y personales, se han publicado numerosas directrices basadas en evidencias para aumentar la concienciación dentro de la comunidad clínica y para mejorar el diagnóstico y la gestión de la rinosinusitis y sus subtipos.3,4
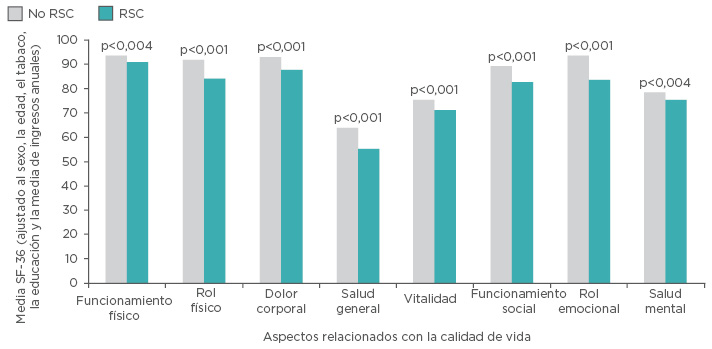
Figura 1: Impacto de la rinosinusitis crónica en la calidad de vida en un estudio basado en una amplia población china (N=1.411).
RSC: rinosinusitis crónica; SF-36: Cuestionario de salud corto de 36 elementos.
Adaptado de Fu et al.7
A los adultos con un riesgo mayor de infecciones en las vías respiratorias superiores (IVRS) se les conoce colectivamente como “adultos frágiles”. Los factores típicos que elevan el riesgo de IVRS incluyen un deterioro en la respuesta inmunológica, tal vez debido a una deficiencia inmunológica o a otros aspectos inmunitarios, como la atopía. Los factores de riesgo medioambientales y comportamentales incluyen el consumo de tabaco y la exposición a la contaminación.9 Las enfermedades crónicas respiratorias también predisponen a los pacientes a una infección aguda debido a las alteraciones fisiológicas.10,11 En los ancianos, el deterioro de la fagocitosis y el proceso de la inmunosenescencia aumentan este riesgo.11
La amplia mayoría (90 %) de las infecciones en las vías respiratorias están provocadas por los virus. Un mal uso y un uso excesivo de los antibióticos en su tratamiento, en concreto en el de la RSC, contribuyen a la resistencia a los antimicrobianos. El antibiótico también puede provocar daños colaterales al dañar la microbiota huésped, que crea un sustrato para próximas infecciones. Más allá del impacto en los individuos directamente afectados, la resistencia antimicrobiana en la enfermedad de las vías respiratorias también representa un riesgo de diseminación de la infección resistente a una población más amplia. Como re sultado, el uso profiláctico del antibiótico para las infecciones en las vías respiratorias solo es adecuado en circunstancias excepcionales, y la disminución del uso del antibiótico resulta urgentemente prioritaria.12-17
La gestión eficaz de las IVRS es también prioritaria, dado el importante impacto individual e incluso socioeconómico, en un ámbito más amplio.18,19 La mayor parte del tratamiento sigue centrándose en el alivio de los síntomas mediante el uso de fármacos antipiréticos y antiinflamatorios dado que, en la mayoría de los casos, las infecciones son víricas y no susceptibles a terapias antimicrobianas. Debido a la limitación de opciones, el enfoque de la gestión debería inclinarse hacia la prevención, en lugar de hacia el tratamiento. En los adultos pueden utilizarse las intervenciones comportamentales y el tratamiento quirúrgico dirigido, especialmente en los adultos frágiles. El uso de los inmunorreguladores para reforzar la capacidad de defensa del sistema inmunitario ofrece una estrategia profiláctica adicional, disponible para los adultos que sufren de infección crónica de las vías respiratorias superiores.20
INFECCIONES RECURRENTES EN LAS VÍAS RESPIRATORIAS EN LA INFANCIA
Las infecciones recurrentes en las vías respiratorias (IRVR) son muy frecuentes en la infancia y pueden resultar extremadamente graves. Desde el punto de vista inmunológico, los niños se enfrentan a un mundo hostil desde el momento en que nacen, con amenazas representadas en forma de antígenos. Las defensas parentales contra este entorno hostil se extienden al sistema inmunitario; no obstante, a los 6 meses de edad, la inmunidad pasiva conferida por la inmonuglobulina (Ig) materna finaliza, y la inmadurez inmunológica crea un entorno en el que las IRVR pueden superar la normalidad en términos de frecuencia y gravedad.
Tras alcanzar un nadir aproximadamente a los 6 meses de edad, cuando la IgG materna ya no puede ser absorbida a causa del cierre intestinal, los niveles de IgG aumentan de manera estable, alcanzando aproximadamente el 80 % de los niveles adultos a los 5 años de edad (Figura 2). No obstante, la principal Ig que protege frente a la inmunidad respiratoria, la IgA, solo alcanza el 40 % de sus niveles adultos a la edad de 5 años (Figura 2). Como resultado, la inmadurez inmunológica queda especialmente marcada en el sistema respiratorio. La maduración de todos los aspectos del sistema inmunitario adaptativo está modulada por el sistema inmunitario innato. Este también muestra una inmadurez funcional tras el nacimiento y, en algunos niños pequeños, las anomalías en la inmunidad innata tendrán efectos resultantes en la inmunidad adaptativa, además de incrementar el riesgo de IRVR. A la par de la inmadurez inmunológica funcional, la inmadurez anatómica del sistema pulmonar aumenta el riesgo de IRVR, que hace de los entornos ricos en antígenos, como las guarderías, un importante desafío.
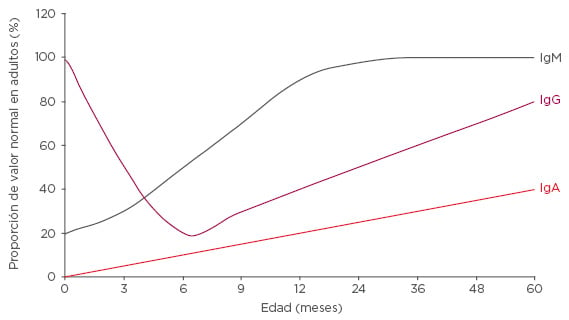
Figura 2: Capacidad de inmunoglobulina como proporción de valores en adultos por edad.
Ig: Inmunoglobulina.
Pueden producirse IRVR en las vías respiratorias superiores (otitis media, mastoiditis, faringoamigdalitis, adenoiditis y rinosinusitis) o en las inferiores (bronquitis/bronquiolitis, traqueítis y neumonía). En ocasiones, las infecciones pueden implicar la totalidad de las vías respiratorias, como en los procesos infecciosos del rinovirus y el virus de la gripe. Las infecciones de las vías respiratorias superiores (IVRS) representan la mayoría (80−90 %) de las infecciones respiratorias;21 Las infecciones respiratorias suelen ser autolimitantes, y las que no se gestionan con facilidad suelen ser las infecciones de las vías respiratorias inferiores (IVRI), mucho más graves y difíciles de tratar.
En la actualidad falta una definición universalmente acordada para las infecciones recurrentes de las vías respiratorias. Seis o más IVRS, o al menos una infección al mes durante otoño e invierno en los niños mayores de 3 años, u ocho o más episodios al año en los niños menores de 3 años, son algunas de las definiciones que se han propuesto como aptas. Para las IVRI, se ha propuesto una tasa más baja de ≥3 episodios al año. Ambas propuestas antes mencionadas hacen referencia a pacientes sin deficiencia inmunológica ni alteraciones funcionales/anatómicas. Un concepto más generalizado de las IRVR utilizado en la actualidad se centra en una frecuencia de infecciones superior en un niño en comparación a otros niños de la misma edad y entorno.
El 25 % de la morbilidad experimentada por los niños a causa de las IVR se produce durante el primer año de vida, que coincide con el nadir inmunológico que acompaña al cierre intestinal con respecto a la IgG. Otro 18 % de la morbilidad se produce en niños de entre 1 y 2 años, tiempo durante el cual suele producirse el pico de exposición a los antígenos debido a la asistencia a las guarderías. Además, el 19 % de todas las muertes infantiles por IVR se produce en los primeros 5 años de vida.22,23
Etiología
La amplia mayoría (90 %) de las IRVR está causada por los virus. Los agentes causales frecuentes incluyen los virus sinciciales respiratorios (VSR), el rinovirus y el virus de la gripe. El 10 % restante de las infecciones implica bacterias, pero en general con un elemento vírico, que se manifiestan como superinfecciones conjuntas víricas/bacterianas. Los agentes causales bacterianos incluyen Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, y Klebsiella pneumoniae, entre otros.
Anteriormente, el VSR se consideraba como el patógeno en las IVR más frecuente durante la infancia. Sin embargo, los datos de los estudios que utilizan técnicas moleculares, como la reacción en cadena de la polimerasa, indican que el rinovirus es, de hecho, el patógeno predominante.24 El rinovirus encuentra un entorno permisivo para la reproducción en los adenoides tras la entrada a través de las vías respiratorias superiores, y desde este punto puede iniciar tanto una IVRS como una IVRI.
La inmadurez inmunológica funcional de los niños pequeños se combina con múltiples factores de riesgo para provocar las infecciones respiratorias, incluyendo la sobreexposición a los antígenos en las guarderías, las alergias, los hermanos, las estaciones, el entorno y la falta de lactancia materna. Un estudio realizado en los Países Bajos demostró directamente el efecto de abordar los factores de riesgo en lugar de la enfermedad en sí misma. La lactancia materna durante ≥6 meses se asoció con una reducción del riesgo de IVRI en niños pequeños ≤4 años, en comparación con niños que nunca fueron amamantados (proporción de probabilidades ajustadas: 0,71; intervalo de confianza del 95 % [IC]: 0,51–0,98).25
La carga de la enfermedad respiratoria es sufrida tanto por el niño como por su familia, lo que da lugar a una carga económica general, absentismo laboral y escolar, mal uso de los antibióticos y resistencia asociada, disminución de la función pulmonar e impacto en la CdV.26 En un estudio realizado en China, los niños de entre 2 y 7 años afectados por las IRVR manifestaron importantes déficits en el funcionamiento físico, emocional, social y escolar (p<0,05).27 Las IVRI son más graves y están asociadas con un incremento del riesgo de padecer sibilancias o asma, hospitalizaciones e incluso muerte.26 La hospitalización por neumonía es una condición grave en niños y adolescentes, y un 21 % de estos pacientes requieren cuidados intensivos. Aproximadamente el 50 % de las hospitalizaciones en este grupo de edad están producidas por un virus único, con un 15 % adicional producido por una coinfección vírica-vírica. Se observan patrones similares en el grupo de edad de <2 años (aproximadamente el 80 % de infecciones únicas y covíricas). Más de la mitad de los niños menores de 2 años hospitalizados por neumonía dieron positivo en VSR o rinovirus, mientras que algo menos de la mitad de los niños de entre 2 y 4 años dieron positivo en VSR y/o rinovirus.27
El predominio de la etiología vírica en lugar de bacteriana en las IVR es más destacado en los niños de preescolar, donde un 95 % de las infecciones en este grupo de edad son víricas. En los niños de edad escolar, la proporción cae hasta aproximadamente el 85 %, y en los adultos es del 80 %. Es posible que la elevada tasa en los niños de preescolar sea mediada al menos parcialmente por el predominio celular de un linfocito T colaborador (Th2) de tipo 2 en el sistema inmunitario funcionalmente inmaduro. Las células Th2 están implicadas en la defensa contra los parásitos, pero tienen una actividad más limitada contra los virus. Además, las células Th2 juegan un papel destacado en la alergia. El efecto combinado del dominio de Th2 y de las IRVR víricas puede dar lugar a sibilancias, que aumentan el riesgo de desarrollar asma. Además, en un típico círculo vicioso, en aquellos pacientes que sí que desarrollan asma, las IVR son uno de los principales desencadenantes del agravamiento.28-30 El predominio extremadamente elevado de las infecciones víricas en niños de preescolar subraya aún más la necesidad de evitar el uso de antibióticos en esta población a menos que sea absolutamente necesario.
Los datos recientes han demostrado que el microbioma de la nasofaringe, que es colonizado durante el primer año, afecta a la gravedad tanto de las IVRI como del asma.31 La colonización temprana de la nasofaringe fue llevada a cabo por Staphylococcus o Corynebacterium, seguido de Alloiococcus; la aparición transitoria de Streptococcus, Moraxella o Haemophilus se asoció con el aumento de las infecciones víricas. La presencia de estas bacterias asociadas a los virus se vinculó con los procesos inflamatorios, un aumento en las posibilidades de IVRI y un aumento en el riesgo de sibilancias o asma. El uso de antibióticos también se asoció con estas especies patógenas, ofreciendo un posible mecanismo tras la presunta asociación entre el uso temprano del antibiótico y el asma.
¿PUEDE MEJORARSE EL MANEJO DE LAS INFECCIONES RECURRENTES DE LAS VÍAS RESPIRATORIAS Y DE LAS ENFERMEDADES RESPIRATORIAS CRÓNICAS?
Conocimiento y detección de los factores de riesgo como primer paso para la prevención de las IRVR. La educación de los padres, la exposición reducida a contaminantes medioambientales, la inmunización activa y el uso de inmunorreguladores son todos factores que podrían mejorar la prevención de las IRVR.32,33 Las revisiones sistemáticas de Cochrane representan la regla por excelencia para la medicina basada en pruebas.34 En el año 2012 se publicó una actualización de la primera revisión Cochrane sobre inmunoestimulantes para la prevención de IVR.35,36 El objetivo del análisis era evaluar la seguridad y la eficacia de los inmunoestimulantes administrados a los niños a modo de terapia profiláctica frente a las IVR. Se incluyeron datos de ensayos aleatorios sobre el uso de los inmunoestimulantes y de los inmunorreguladores para el control de las IVR en niños ≤18 años. El principal resultado de interés fue el número de infecciones respiratorias agudas durante el periodo de análisis. Se excluyó a los niños con alergias, asma, malformaciones anatómicas, síndrome de Down u otras formas de inmunodeficiencia.36
De los 764 estudios identificados, se incluyeron 61 estudios, que abarcaban a 4000 pacientes. De los estudios incluidos, 45 duraron <6 meses, 35 duraron 6 meses y 2 duraron >6 meses. Se evaluaron los estudios incluidos en cuanto a calidad (nivel A, B o C) antes de la extracción de datos. Los datos extraídos revelaron una importante heterogeneidad y variabilidad en los ensayos. Los inmunoestimuladores demostraron reducir las IVR (-1,24; 95 % IC: -1,54–[-0.94]), con una diferencia en tasas de -39 % (95 % IC: -46,37–[-31.31]). La calidad global de las muestras de cualquier inmunoestimulante frente a placebo fue moderada y dependía del número de IVRS en el grupo de control.36
Los datos procedentes de los estudios sobre inmunorreguladores derivados de bacterias mostraron la menor heterogeneidad y variabilidad, particularmente los estudios que investigaban los efectos del lisado bacteriano OM-85. De los 12 estudios con OM-85 evaluados, todos tuvieron una duración de ≥6 meses. Cuatro ensayos con OM-85 fueron los únicos estudios calificados con nivel A entre los inmunorreguladores bacterianos, y los otros 8 estudios con OM-85 mostraron una calidad de nivel B. La reducción en el número total de infecciones agudas en las vías respiratorias en comparación con el placebo fue del 35,90 % (95 % IC: -49,46–[-22.35]).
Profilaxis con OM-85 en niños de alto riesgo
Se evaluó la profilaxis con OM-85 en un estudio de 6 meses de duración en niños de entre 3 y 5 años con historial de IRVR y subclases de IgG inferiores a lo normal (N=54).37 La frecuencia de las subclases de IgG inferiores a lo normal fue elevada en esta población (78 %), y el OM-85 redujo significativamente la incidencia de IVR agudas en aproximadamente un 40 %. Un ensayo independiente y aleatorio doble ciego investigó el uso de OM-85 en la ciudad de Chihuahua, México, en niños de entre 1 y 12 años (N=54) con historial de IRVR. El ensayo se llevó a cabo durante 12 meses e incluyó dos programas de dosificación de 3 meses de duración de OM-85, de 3,5 mg/día durante 10 días/mes (dosis estándar) o placebo. La profilaxis con OM-85 dio lugar a una reducción en el uso de antibiótico a partir del segundo mes, incluyendo los meses de invierno con prevalencia de un clima extremo, que se vio reflejado en una reducción en el número de IVR.38
La sobreexposición a los patógenos respiratorios es común en los orfanatos. Desde el punto de vista del investigador, los orfanatos también tienen la ventaja de ofrecer un entorno homogéneo para los participantes en un estudio. Un ensayo aleatorio doble ciego controlado por placebo investigó el uso de OM-85 en niñas de entre 6 y 13 años (N=200) que vivían en un orfanato. Las participantes recibieron profilaxis con OM-85 en la dosis estándar antes mencionada o bien placebo. Durante el seguimiento de 6 meses posterior, que se extendió a lo largo del invierno, las participantes que recibieron OM-85 mostraron una reducción del 50 % en la incidencia de IVR. Todas las niñas no tratadas requirieron terapia con antibiótico, mientras que aproximadamente el 50 % de las pacientes que recibieron profilaxis con OM-85 también recibieron antibiótico. La reducción relativa del riesgo aumentó con la mayor frecuencia de IVR, con una reducción del riesgo para ≥3 IVR de 0,2 frente al placebo, lo que indicó una reducción del riesgo de un 80 %. Además de representar una reducción en la carga de la enfermedad para las pacientes, que incluyó la disminución del absentismo escolar, estos cambios dieron lugar a un importante ahorro de costes para la institución.39 De igual forma, en un estudio multicéntrico de diseño abierto llevado a cabo en un orfanato, el OM-85 redujo las infecciones, el uso de antibiótico y el absentismo escolar cuando se administraba en la fase aguda de la infección. Además, el OM-85 mostró un aumento del efecto protector en aquellos pacientes con historial de infecciones más frecuentes.40
Al igual que en todas las intervenciones médicas, la seguridad de los inmunorreguladores es una consideración clave. Los datos de la revisión Cochrane de 2012 mostraron que el OM-85 tiene una diferencia de riesgo cercana a cero, en comparación con el placebo (0,01; 95 % IC: 0,01–0,03).36 Los eventos adversos documentados fueron de carácter leve y consistían en eventos gastrointestinales, que incluían diarrea o reacciones cutáneas.
Eficacia en las infecciones agudas de las vías respiratorias
Los datos antes mencionados, así como otros estudios similares como el de Chen et al.,41 en niños en remisión de RSC, demostraron que el OM-85 tiene un efecto profiláctico en las IRVR. Aunque su papel principal se da en la profilaxis, los estudios controlados y de diseño abierto han demostrado que el OM-85 acelera la recuperación de los pacientes cuando se utiliza durante la fase aguda del proceso infeccioso. En un ensayo aleatorio doble ciego en niños de edades entre los 18 meses y los 9 años (N=56) con rinosinusitis subaguda, la terapia con OM-85 redujo la convalecencia (15,38±8,91 días frente a 20,28±7,17 días) y fomentó una recuperación más rápida (5,56±4,98 días frente a 10±8,49 días) en comparación con el uso de placebo en estos niños.42 Se obtuvieron resultados similares que mostraban los efectos curativos y profilácticos del OM-85 en otro estudio con respecto a los episodios agudos de RSC en los niños.43
Inmunogenicidad
La vacuna es la principal medida preventiva contra las infecciones víricas. En un estudio simple ciego aleatorizado y prospectivo, de 6 meses de duración, se investigaron la seguridad, la eficacia y la inmunogenicidad en los niños (N=68) que recibieron OM-85 combinado con la vacuna contra la gripe. La incidencia, la media y la prevalencia de IVR fueron todos significativamente inferiores en niños que recibieron profilaxis con OM-85, en comparación con la profilaxis únicamente con vacuna. Los días de escuela que faltaron y los tratamientos de antibiótico tomados también fueron destacadamente menores en el grupo con profilaxis combinada. Además, no hubo diferencia en la IgG e IgM de la vacunas contra la influenza inactivada, lo que indica que el OM-85 no interfirió con la respuesta inmunológica a la vacuna.44
LOS INMUNORREGULADORES EN LAS DIRECTRICES DE LA RINOSINUSITIS
En el estudio de posición actual europeo sobre adultos con rinosinusitis, la profilaxis con OM-85 en la RSC sin pólipos nasales muestra un nivel de evidencia de 1B y un grado A de recomendación, siendo el segundo nivel de evidencia más elevado, solo por debajo de los esteroides nasales.20 Las directrices panamericanas establecen que el efecto beneficioso de las preparaciones de lisados bacterianos en adultos reducen la proporción de recurrencia en la rinosinusitis vírica y bacteriana, y que los beneficios de dichos lisados bacterianos compensan los riesgos. Estas directrices también recomiendan la terapia mediante lisados bacterianos para la RSC sin pólipos, aunque faltan suficientes pruebas para la RSC con pólipos.45 Actualmente no existe ninguna recomendación orientativa sobre el uso de lisados bacterianos en los niños. No obstante, y tal como se detalló anteriormente, los datos procedentes de diversas regiones geográficas y poblaciones pediátricas sugieren un beneficio, y las directrices brasileñas mencionan que el beneficio de la terapia con lisado bacteriano en niños con IRVR que puede dar lugar a la RSC.46
CONCLUSIÓN
Los niños y los adultos frágiles son especialmente vulnerables al desarrollo de IRVR, así como de afecciones crónicas como la RSC. Dado que la definición de la recurrencia varía, la interpretación de la investigación y la elección de la opción terapéutica óptima para sus pacientes puede resultar todo un desafío. Tratar cada caso de manera individual, tanto desde un punto de vista patológico como centrado en el paciente, puede ayudar a dirigir el tratamiento. Al evaluar las IRVR, hay que tener en cuenta los factores de riesgo, debe considerarse la importancia del microbioma de las vías respiratorias superiores y tener presente la importancia clave del uso racional y mínimo de los antibióticos. Dadas las consecuencias resultantes de las IRVR en cuanto al aumento del riesgo de asma, la hospitalización, la morbilidad y la mortalidad, la profilaxis adecuada sigue siendo una necesidad principal no satisfecha. Deberían tenerse en cuenta las intervenciones comportamentales, las intervenciones médicas y quirúrgicas dirigidas y la estimulación o inmunorregulación no específica en el contexto de las circunstancias particulares de cada paciente. Los inmunorreguladores deberían ser una parte fundamental de la estrategia preventiva del médico, junto con un diagnóstico correcto, un control del entorno, una nutrición eficaz y el uso adecuado de otras medicaciones. El inmunorregulador de lisados bacterianos OM-85 constituye la base factual más robusta y coherente. En las IRVR, el OM-85 ha demostrado reducir la incidencia, la convalecencia y el uso de antibióticos, además de resultar más eficaz en niños con factores de riesgo, como aquellos que van a la guardería o que viven en un orfanato. Además, ha demostrado ser eficaz y tolerarse bien en combinación con la vacuna contra la gripe, a la par que acelera la recuperación y disminuye la convalecencia durante la gestión activa de la rinosinusitis.